
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопросы для выполнения контрольной работы 1 страница
|
|
|
|
1. Единицы количества вещества. Способы выражения концентрации растворов.
2.Содержание аскорбиновой кислоты в настое шиповника составляет 5,5 мг в 1л. Выразите содержание аскорбиновой кислоты в массовой доле.
3. Как рассчитывается фактор эквивалентности кислот, оснований, солей? Приведите примеры.
4. Укажите фактор эквивалентности и молярную массу эквивалента фосфорной кислоты в следующих реакциях:
H3PO4 + KOH = KH2PO4 + H2O
H3PO4 + 2KOH = K2HPO4+ H2O
H3PO4 + 3KOH = K3PO4 + H2О
5. Сформулируйте закон эквивалентов. Напишите математические выражения закона эквивалентов.
6. Что такое метод и методика проведения анализа?
7. Чем определяется чувствительность метода или методики анализа?
8. Что такое экспрессность метода?
9. Приведите 5-7 примеров аналитических сигналов, измерение которых лежит в основе методов химического анализа.
10. Что называют погрешностью химического анализа? Какие погрешности бывают?
11. Хлорид кальция широко используется в лечебной практике. Определите, сколько грамм кристаллического CaCl2 * 6H2O и воды потребуется для приготовления 100 мл 3%-ного раствора (плотность=1г/мл). Рассчитайте молярную концентрацию, молярную концентрацию эквивалента и титр этого раствора.
12. В качестве вяжущего и асептического средства в медицине используют хлорид цинка. Определите молярную концентрацию, молярную концентрацию эквивалента и титр раствора, содержащего 5 г хлорида цинка в 100 г раствора (плотность=1г/мл).
13. С помощью перманганата калия можно лечить змеиные укусы при отсутствии специальной сыворотки. Для этого в место укуса вводят шприцем 0,5 – 1,0 мл 1%-ного раствора перманганата калия. Рассчитайте массу перманганата калия и объем воды, необходимые для приготовления 75 мл такого раствора, имеющего плотность=1,006 г/мл. Определите молярную концентрацию, молярную концентрацию эквивалента и титр раствора, если Мэкв. (KMnO4) = 1/5М (KMnO4).
14. 3%-ный раствор пероксида водорода, а также 30% раствор Н2О2 («пергидроль») используют в медицине. Определите, какой объем воды надо добавить к 5 мл 30%-ного раствора Н2О2, чтобы получить 3%-й раствор.
15. В лечебной практике в качестве кровоостанавливающего и противоаллергического средства применяют раствор хлорида кальция. Определите массу хлорида кальция, необходимую для приготовления 200 мл 15%-ного раствора, а также молярную концентрацию, молярную концентрацию эквивалента и титр данного раствора (плотность= 1,07 г/мл).
16. В медицине применяется 5-10%-ные спиртовые растворы йода для обработки ран, ссадин, операционного поля. Определите, какой объем 5%-ного раствора можно приготовить из 10 г кристаллического йода. Чему равна молярная концентрация и титр данного раствора? (плотность= 0,950г/мл).
17. В желудочном соке человека массовая доля соляной кислоты составляет в среднем 0,5%. Сколько моль соляной кислоты содержится в 500 г желудочного сока? Рассчитайте молярную концентрацию, молярную концентрацию эквивалентов и титр соляной кислоты, принимая плотность равной 1г/мл.
18. При ожогах щелочами пораженный участок кожи в течение нескольких минут промывают водой, а затем нейтрализуют раствором уксусной кислоты с массовой долей 1%. Определите, какая масса уксусной эссенции с массовой долей кислоты 60% необходима для приготовления 500 г 1%-ного раствора.
19. Какие ошибки называются систематическими? Случайными? Перечислите важнейшие виды систематических ошибок.
20. При охлаждении 300 г 15%-ного раствора часть растворенного вещества выпала в осадок, и концентрация раствора стала равной 8%. Чему равна масса выпавшего в осадок вещества?
Раздел 2. КАЧЕСТВЕННЫЙ АНАЛИЗ
Качественный анализ - совокупность химических, физико-химических, физических методов, применяемых для обнаружения и идентификации элементов, ионов или соединений, входящих в анализируемое вещество, или смесь веществ.
Качественный анализ всегда предшествует количественному.
Термины и понятия качественного анализа
1. Аналитическая (качественная) реакция - это реакция, которая сопровождается заметным внешним эффектом, позволяющим установить, что химический процесс происходит с: выделением или растворением осадка, изменением окраски анализируемого раствора, выделением газообразных веществ.
2. Специфическая реакция - это реакция, которая позволяет обнаружить ион в присутствии любых других ионов.
3. Чувствительность реакции - свойство реакции обнаружить минимальное количество вещества в минимальном объеме раствора. Количественно чувствительность реакций характеризуют двумя величинами: обнаруживаемым минимумом и минимальной концентрацией.
4. Обнаруживаемый минимум – наименьшая масса иона, которую удается обнаружить данной реакцией, выражается в микрограммах (1мкг=10-6г).
5. Минимальная концентрация показывает, при каком разбавлении раствора аналитическая реакция еще дает положительный результат.
6. Групповой реактив - реактив, действующий внешне одинаково на группу ионов и позволяющий выделить эту группу из сложной смеси.
7. Мешающие ионы - это ионы, присутствие которых в растворе не позволяет увидеть внешний эффект реакции от действия реактива на определенный ион.
8. Удалить ион из раствора - понизить концентрацию иона до минимального значения.
9. Проверить полноту осаждения - после удаления иона из раствора убедиться в отсутствии удаляемого иона путем повторного добавления реактива - осадителя.
Виды учебных занятий при качественном анализе
1. Выполнение качественных реакций на конкретный ион с четким соблюдением всех условий проведения каждой реакции и наблюдением за внешним эффектом реакции. В этом случае точно известно, что данный ион в растворе есть, а мешающие ионы отсутствуют.
2. Решение аналитической задачи, т.е. анализ качественного состава исследуемого раствора. Здесь не известно, какие ионы есть в растворе. Добавляя к испытуемому раствору определенные реактивы, получают или не получают внешние эффекты, на основании чего делают выводы о наличии или отсутствии ионов в растворе и их количестве (рис. 1).

Рис 1. Схема проведения анализа
Два способа решения аналитической задачи:
1. Дробный метод анализа - обнаружение ионов с помощью специфических реакций в отдельных порциях анализируемого раствора, проводимое в любой последовательности.
2. Систематический анализ - это определенная последовательность выполнения аналитических реакций, при которой каждый ион открывается лишь после того, как будут открыты и удалены все другие ионы, мешающие его обнаружению.
2.1. Анализ катионов
Классификация катионов
Применяют два основных варианта классификации катионов:
- сероводородный;
- кислотно-шелочной.
В основе классической сероводородной (сульфидной) системы качественного анализа лежит растворимость сульфидов. Преимущество этой классификации ионов заключается в том, что многие катионы с S2- дают цветные осадки. Но в процессе работы применяется сероводород с резким удушливым запахом, который требует специально оборудованных лабораторий с мощной вытяжной системой. В учебных лабораториях Н2S и, следовательно, сероводородная классификация почти не используются.
Кислотно-щелочная система, разработанная в свое время С.Д. Бесковым и О.А. Слизковской, основана на различном отношении катионов к кислотам, щелочам и водному раствору аммиака. В соответствии с этим принципом классификации все катионы делятся на шесть аналитических групп (приложение, табл. 1).
2.2. Классификация анионов
Общепринятой классификации анионов не существует. Разными авторами предложены различные системы их классификации.
Классификация, по которой все анионы делятся на три аналитические группы в зависимости от растворимости солей бария и серебра, приведена в приложении, табл. 2.
Вопросы для выполнения контрольной работы
21. Аналитические реакции. Примеры уравнений таких реакций. Требования, предъявляемые к аналитическим реакциям. Какие анионы относятся к первой аналитической группе? Охарактеризуйте их свойства. Напишите реакции открытия сульфат - иона.
22. Характеристика катионов первой аналитической группы. Охарактеризуйте свойства этих катионов. Приведите примеры основных частных реакций на катионы первой группы. Условия выполнения данных аналитических реакций. Приведите специфическую реакцию на один из ионов этой группы (по кислотно-основной классификации).
23. Характеристика катионов второй аналитической группы. Указать групповой реактив и привести уравнения реакций действия его на катионы группы в молекулярном и ионном виде. Привести уравнение специфической реакции на ион Pb2+ в молекулярном и ионном виде с описанием условий проведения реакции (по кислотно-основной классификации).
24. Перечислите катионы третьей аналитической группы. Охарактеризуйте свойства соединений этих катионов (растворимость их оснований и солей). Действие группового реактива на катионы данной группы. Составить уравнения реакций в молекулярном и ионном виде (по кислотно-основной классификации).
25. Перечислите катионы четвертой аналитической группы. Охарактеризуйте свойства соединений этих катионов (растворимость их оснований и солей). Действие группового реактива на катионы данной группы. Составить уравнения реакций в молекулярном и ионном виде (по кислотно-основной классификации).
26. Классификация анионов. Какие анионы относятся ко второй аналитической группе? Охарактеризуйте их свойства. Составьте уравнения реакций их открытия (кислотно-основная классификация).
27. Дайте характеристику групповому реактиву. Перечислите групповые реактивы на катионы V, VI аналитических групп по кислотно-основной классификации. Напишите уравнения реакций для данных катионов в молекулярной и ионной форме.
28. Виды учебных заданий в качественном анализе. Дробный и систематический анализ. Какие реакции лежат в основе дробного анализа? Приведите примеры уравнений таких реакций в молекулярном и ионном виде. Опишите ход проведения систематического анализа для смеси катионов первой и второй групп (по кислотно-основной классификации).
29. Перечислите катионы, относящиеся к IV аналитической группе по кислотно-основной классификации, укажите групповой реактив, его действие, охарактеризуйте свойства этих катионов. Напишите уравнения частных реакций для иона Zn2+.
30. Характеристика катионов пятой аналитической группы по кислотно-основной классификации. Действие группового реактива. Напишите уравнения реакций в молекулярном и ионном виде. Какой реактив является специфическим для обнаружения иона Fe2+? Представьте действие его в молекулярном и ионном виде, указав внешний эффект, и дайте название образующемуся веществу.
31. Классификация анионов. Охарактеризуйте аналитические группы анионов и действие на них групповых реактивов. Составьте уравнения реакций для анионов первой аналитической группы в молекулярном и ионном виде (по кислотно-основной классификации).
32. Что такое специфическая реакция? Приведите примеры уравнений специфических реакций для катионов пятой аналитической группы (Fe3+, Fe2+, Mn2+). Опишите внешние эффекты. Дайте названия образующимся веществам (используйте кислотно-основную классификацию).
33. Опишите ход анализа по определению смеси катионов первой и второй аналитической групп, используя кислотно-основную классификацию. Что позволяют установить предварительные испытания. В чем суть систематического анализа? На чем основано отделение ионов первой аналитической группы от второй. Приведите уравнения соответствующих реакций.
34. Характеристика анионов третьей аналитической группы по кислотно-основной классификации. Опишите реакции обнаружения данных ионов в растворе и условия их проведения. Приведите уравнения соответствующих реакций в молекулярном и ионном виде.
35. Характеристика качественного анализа. Что такое качественная реакция? Рассмотрите главные особенности качественных реакций (специфичность, интенсивность, чувствительность, селективность и др.) Приведите примеры качественных реакций для катиона Fe3+.
36. Дайте определение специфической реакции. Укажите специфическую реакцию на анион йода. К какой аналитической группе по кислотно-основной классификации относится данный анион? Охарактеризуйте эту группу.
37. Что такое групповой реактив? Перечислите групповые реактивы на катионы второй, третьей и четвертой аналитических групп. Напишите уравнения реакций взаимодействия группового реактива соответствующей группы с ионами Pb2+, Ba2+, Al3+(по кислотно-основной классификации).
38. Аналитические реакции. Примеры. Требования, предъявляемые к аналитическим реакциям. Напишите примеры качественных реакций для обнаружения ионов меди, цинка, свинца. К каким аналитическим группам относятся данные катионы. Охарактеризуйте эти группы.
39. Что такое мешающие ионы? Опишите порядок обнаружения в растворе ионов калия и натрия в присутствии катионов второй аналитической группы и аммония. (рассматривайте классификацию ионов по кислотно-основному методу). Составьте уравнения реакций в молекулярном и ионном виде. Укажите условия их проведения.
40. Опишите порядок аналитического исследования неизвестного вещества посредством качественных реакций. Охарактеризуйте и подробно опишите операции анализа (предварительное испытание, растворение пробы, открытие катионов, открытие анионов).
Раздел 3. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Методы количественного анализа
Количественный анализ основан на функциональной зависимости между количеством элемента или вещества (или их концентрацией) и измеряемой физической величиной. Многочисленные методы количественного анализа делятся на химические и физические. Классифицируются они по измеряемым физическим величинам
3.1. Гравиметрический (весовой) анализ
Гравиметрия - один из самых точных методов количественного анализа. Здесь взвешивание является не только начальной (промежуточной), но и конечной стадией определения (процедура взвешивания как промежуточная операция используется во многих методах анализа).
Основным инструментом анализа являются аналитические весы, точность их измерения (взвешивания) 10-5 – 10-6 .Точность весового анализа до 0,01.
Направления использования гравиметрии:
а) определение содержания различных веществ (примесей) или элементов в сельскохозяйственных объектах анализа;
б) определение содержания органической или минеральной составляющей в анализируемом объекте;
в) определение содержания гигроскопической или кристаллизационной воды.
Определение содержания различных веществ (примесей) или элементов в сельскохозяйственных объектах. Из части исследуемого вещества известной массы (навеска) определяемый компонент выделяют тем или иным способом в виде какого-либо соединения. Выделение определенного компонента осуществляется после растворения навески и действия на раствор подходящего реагента, образующего практически нерастворимое вещество (форма осаждения). Осадок отделяют фильтрованием, декантацией или другими способами, отмывают от следов сорбированных компонентов, часто переосаждают. Затем взвешивают и прокаливают до образования устойчивого соединения строго определенного состава (весовая форма), массу которого измеряют (завешивают).
Расчеты осуществляют в соответствии с реализованными химическими реакциями.
Определение содержания органической или минеральной составляющей в анализируемом объекте. Часть исследуемого вещества известной массы (навеска) сжигают (озоляют) до постоянной массы.
Расчеты осуществляют в двух вариантах:
а) вычисление содержания минеральной составляющей (отнесение массы остатка после сжигания к массе взятой навески);
б) вычисление содержания органической составляющей (отнесение потери массы после обжига к массе взятой навески).
Определение воды в веществах. На практике чаще всего определяют содержание гигроскопической воды (влажность) и кристаллизационной связанной воды, входящей в состав кристаллогидратов. В этих целях берется точная навеска исследуемой средней пробы массой 1-3 г и высушивается в сушильном шкафу при определенной температуре до постоянной массы. Температура сушки 100...110°С (для волокнистых веществ 100... 102°С, для почв около 105°С, для известняка 108...110°С, карбоната натрия - до270°С).
Вопросы для выполнения контрольной работы
41. Гравиметрический анализ. Перечислите основные требования к осадку. Отличие осаждаемой формы от весовой. Сколько мл 0,5н раствора оксалата аммония потребуется для осаждения иона кальция из раствора, полученного при растворении 0,7 г карбоната кальция?
42. Охарактеризуйте основные операции гравиметрического анализа. Определите содержание бария в образце химически чистого BaCl2 ∙ 2H2 O, если навеска чистого BaCl2 ∙ 2H2 O равна 0,4872 г. Масса осадка сульфата бария после прокаливания составила 0,4644 г.
43. Характеристика гравиметрического метода анализа. Преимущества и недостатки метода. Применение метода в сельском хозяйстве.
44. Операции гравиметрического анализа. Требования к осадителю. Для количественного определения иона бария растворили навеску BaCl2 ∙ 2H2O в 0.4526 г. Какой объем 2н раствора серной кислоты потребуется для полного осаждения иона бария?
45. Весовой анализ. Основные операции весового анализа. Требования, предъявляемые к осадкам (аморфным и кристаллическим). Сколько мл 1н раствора хлорида бария потребуется для осаждения сульфат - иона, если растворено 2 г медного купороса, содержащего 5% примесей? Учтите избыток осадителя.
46. Гравиметрический анализ. Что называется «навеской»? Чем определяется выбор величины навески анализируемого вещества? На аналитических весах отвесили навеску в 0,7178 г х.ч. хлорида кальция. Приготовили из нее 250 мл раствора. Определите эквивалентную концентрацию и титр данного раствора.
47. Охарактеризуйте основные этапы весового анализа.
48. Гравиметрический анализ. Определение содержания различных веществ (примесей) или элементов в сельскохозяйственных объектах.
49. Опишите определение кристаллизационной воды в медном купоросе гравиметрическим методом.
50. Весовой анализ. Преимущества и недостатки данного метода анализа. При определении железа весовым методом из 1,5 г вещества было получено 0,48 г Fe2O3. Чему равна массовая доля железа в образце?
51. Гравиметрия. Преимущества и недостатки метода. Задача: при анализе 0,8105 г сплава получено 0,5008 г Al2O3. Определите процентное содержание алюминия в сплаве.
52. Весовой анализ. Перечислите условия осаждения кристаллических и аморфных веществ. Что такое форма осаждения и весовая (гравиметрическая) форма? Какую навеску сульфата железа FeSO4∙ 7H2O следует взять для определения в нем железа в виде Fe2O3 (считая норму осадка равной примерно 0,2 г).
53. Характеристика гравиметрического анализ. Что называется «навеской»? Чем определяется выбор величины навески анализируемого вещества? Для анализа взято 0,5850 г хлорида бария. При его обработке серной кислотой образовался осадок сульфата бария в количестве 0,5642 г. Сколько граммов бария входит в состав осадка? Определить процентное содержание бария во взятой навеске.
54. Аналитические определения весовым методом. Что называется «навеской»? Чем определяется выбор величины навески анализируемого вещества? Основные операции весового анализа.
55. Операции гравиметрического анализа. Требования к осадку и осадителю. Для количественного определения иона бария растворили навеску BaCl2 ∙ 2H2 O в 0.5241 г. Какой объем 1,5н раствора серной кислоты потребуется для полного осаждения иона бария?
56. Определения методом гравиметрии. Перечислите условия осаждения кристаллических и аморфных веществ. Что такое форма осаждения и весовая (гравиметрическая) форма? Каким требованиям они должны отвечать?
57. Какой объем 0,8н раствора хлорида бария потребуется для осаждения сульфат - иона, если растворено 2,4 г медного купороса, содержащего 10% примесей?
58. Какой объем 0,15н раствора серной кислоты потребуется для осаждения ионов бария из навески нитрата бария величиной 0,55 г?
59. Гравиметрия. Основные операции данного метода. Перечислите условия осаждения кристаллических и аморфных веществ, нормы их для анализа. Что такое форма осаждения и весовая (гравиметрическая) форма? Для определения содержания сульфата калия гравиметрическим методом из 3,5 г образца, содержащего сульфат калия, было получено 3,12 г сульфата бария. Определите массовую долю сульфата калия в образце.
60.Весовой анализ. Основные операции данного метода. Как осуществляют определение кристаллизационной воды в кристаллогидрате? Опишите ход данного определения. Задача: вычислите процентное содержание кристаллизационной воды в медном купоросе по следующим данным: масса пустого тигля 3,52456г, масса тигля с навеской 4,74115г, масса тигля с навеской после высушивания 4,30355г.
3.2. Титриметрический (объемный) анализ
Задачи и методы объёмного анализа
Объемный анализ основан на точном измерении объема раствора реактива, затраченного на реакцию с определяемым компонентом. Задача объемного анализа - определение эквивалентной концентрации раствора одного вещества по известной эквивалентной концентрации раствора другого вещества, а также определение количественного содержания анализируемого вещества в растворе.
В зависимости от химических реакций, лежащих в основе метода, их подразделяют на следующие методы (приложение, табл. 3).
В основе всех расчетов в объемном анализе лежит закон эквивалентов для реагирующих растворов.
Сэкв1žV1 = Сэкв2žV2,
где Сэкв1 - эквивалентная концентрация первого раствора,  ;
;
V1 — объем первого раствора, л;
C’экв1 · V1= nэкв – число моль-экв.первого растворенного вещества.
 ·[л]=[моль-экв]
·[л]=[моль-экв]
С экв2 V 2 - число моль-экв.второго растворенного вещества.
Равенство nэкв1 = пэкв2 называют точкой эквивалентности или моментом окончания реакции. В точке эквивалентности число моль-экв. анализируемого вещества равно числу моль-экв. партнера по реакции.
Для успешного проведения объемного анализа необходимо, чтобы:
1. Растворенные вещества реагировали между собой с достаточно большой скоростью и реакции были необратимы (при реакциях, имеющих небольшую скорость, весьма трудно, а часто даже невозможно определить конец титрования, вследствие чего раствор будет перетитрован);
2. Момент окончания реакции (точка эквивалентности) четко и хорошо определялся. В методе нейтрализации для фиксирования точки эквивалентности в раствор вводится индикатор;
3. Объем растворов реагирующих веществ был измерен очень точно;
4. Концентрация одного из растворов была известна (такой раствор называется рабочим раствором или титрантом).
Концентрации, применяемые в объёмном анализе
В объемном анализе концентрацию растворов главным образом выражают в моль-экв/л (эквивалентная концентрация Сэкв) и г/мл (титр, Т). Титр (Т) показывает, сколько граммов растворенного вещества содержится в 1 мл раствора.
Например, THCL = 0,03604 мл. Это означает, что каждый миллилитр этого раствора содержит 0,03604 г НСl.
Эквивалентная концентрация (Сэкв) показывает, сколько моль - эквивалентов растворенного вещества содержится в 1л (1000 мл) раствора. Так, например, 1 л 0,1н раствора серной кислоты содержит 0,1 моль-экв. H2SO4, а 1 л 5н раствора содержит 5 моль-экв. H2SO4.
Число моль - эквивалентов рассчитывается по формуле
nэкв=  ,
,
где m - масса вещества;
Мэкв- молярная масса эквивалента вещества.
Титр связан с эквивалентной концентрацией соотношением:
Т = 
Молярная масса эквивалентов веществ в общем виде рассчитывается по
формулам:
Мэкв(кислоты)=  ,
,
Мэкв(основания)=  ,
,
Мэкв(соли)=  ,
,
где М - молярная масса вещества; ∑Н+ - сумма ионов водорода;
∑ОН - сумма гидроксильных групп;
n - число катионов в молекуле соли;
Z - заряд катиона.
Молярная масса эквивалентов веществ может иметь различную величину в зависимости от условий протекания реакции.
Например, в реакции:
Н3РО4 + NaOH = NaH2PO4 + Н2О
М экв (Н3РО4) =  = 98 г/моль-экв.
= 98 г/моль-экв.
Если в ходе реакции в молекуле фосфорной кислоты замещены 2 иона водорода, то:
Н3РО4 + 2NaOH = Na2HPO4 + 2Н2О
Мэкв(Н3РО4)=  =
= 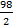 = 49 г/ моль-экв.
= 49 г/ моль-экв.
В окислительно-восстановительных реакциях молярная масса эквивалента вещества определяется по формуле:
Мэкв= 
где n - число отданных или принятых электронов одной молекулой восстановителя или окислителя.
Например, в реакции:
2КМпО4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3Н2О
окислитель восстановитель
Схема электронного баланса:
Mn+2 + 5 e → Mn+2 │5│2│
N+3 _ 2e→ N5+ │2│5│
Мэкв(KMnO4)=  =
=  = 31,6 г/моль-экв.
= 31,6 г/моль-экв.
Мэкв(NaNO2) =  =
=  = 34,5 г/моль-экв.
= 34,5 г/моль-экв.
Вычисления в объемном анализе
1. Вычисления, связанные с приготовлением и разбавлением растворов.
Существуют 5 способов выражения концентрации растворов: молярная (См), эквивалентная (Сэкв), титр (Т), моляльная (Сm), процентная (С%).
В практике объемного анализа обычно используются эквивалентная концентрация и титр, поэтому часто приходится проводить вычисления, связанные с переходом от одной концентрации к другой.
Пример 1. Вычислите молярную и эквивалентную концентрации 12%-го раствора серной кислоты плотностью 1,08г/мл.
Решение:
а) по условию задачи имеем 12%-й раствор. Следовательно, 12 г H2SO4 содержится в 100 г раствора. Зная массу и плотность раствора, можно найти объем раствора по формуле:
V р-ра =  =
=  = 92,59 мл
= 92,59 мл
б) далее составляем пропорцию:
12г H2SO4 содержится в 92,59мл раствора
X г H2SO4 содержится в 1000мл раствора
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 3032; Нарушение авторских прав?; Мы поможем в написании вашей работы!