
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопросы для выполнения контрольной работы 2 страница
|
|
|
|
X =  = 129г
= 129г
в) зная, что в 1л раствора содержится 129г серной кислоты, легко можно определить молярную и эквивалентную концентрации:
M(H2SO4)= 98 г/моль
См (nмоль в 1 л р-ра) = 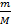 =
= 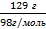 = 1,3 моль,т.е. р-р1,3М
= 1,3 моль,т.е. р-р1,3М
Mэкв (H2 SO4) = 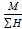 =
= 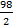 = 49г / моль - экв.
= 49г / моль - экв.
Сэ (nэкв в 1л р-ра) = 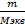 =
= 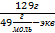 =2,6моль - экв., т.е раствор 2,6н
=2,6моль - экв., т.е раствор 2,6н
Пример 2. Сколько миллилитров 38,3%-го раствора соляной кислоты (р=1,19г/мл) необходимо взять, чтобы приготовить 10 л 0,1 н раствора?
Решение: а) сначала находим, сколько граммов НCl должен содержать приготовленный раствор. Составим пропорцию:
0,1 моль-экв. HCl содержится в 1 л раствора
Х моль-экв. HCl содержится в 10 л раствора
Х 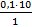 = 1 моль-экв.
= 1 моль-экв.
mHCl = nэкв · Мэкв = 1 · 36,5г
Мэкв(HCl) =  = 36,5 г/ моль-экв.
= 36,5 г/ моль-экв.
б) рассчитаем массу 38,3%-го раствора, содержащего 36,5 г НCl
38,3г НCl содержится в 100 г раствора
36,5г НCl содержится в Y г раствора
Y = 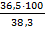 = 92,2г
= 92,2г
в) зная массу 38,3%-го раствора и его плотность, находим объем раствора по формуле:
Yр-ра = 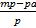 =
= 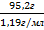 = 80мл
= 80мл
Следовательно, для приготовления 10л 0,1 н раствора нужно взять 80мл 38,3%-го раствора НCl, отмерив ее мерным цилиндром, и добавить воды до объема 10л.
Пример 3. Сколько литров воды нужно добавить к 0,5 л 8,8н раствора CuSO4, чтобы получить 0,2н раствор?
Решение: задача решается по закону эквивалентов для реагирующих растворов:
Cэкв1· V1 = Cэкв2 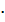 V2
V2
V2 = 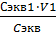 =
= 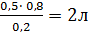
VH2O = V2 – V1 = 2 – 0,5 = 1,5л
2. Расчеты, связанные с вычислением результатов титрования.
Пример 1. Сколько граммов карбоната натрия Na2CO3 было взято, если после растворения его в мерной колбе на 250 мл и доведения водой до метки, взяли 25 мл пипеткой и на титрование этого количества раствора пошло 20,2мл 0,101 н раствора соляной кислоты?
Решение: по закону эквивалентов для реагирующих растворов находим эквивалентную концентрацию раствора карбоната натрия (объемы растворов необходимо перевести в литры):
Сэкв ·V1 = Сэкв · V2
Cэкв(Na2CO3)· 0,025 = 0,101 · 0,0202
Cэкв(Na2CO3)· =0, 0816н
Зная эквивалентную концентрацию, можно рассчитать титр раствора по формуле:
Т= 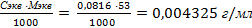
Массу карбоната натрия в 250мл раствора можно найти из пропорции:
0,004325г Na2CO3 - в 1 мл раствора
X г Na2CO3 – в 250 мл раствора
X 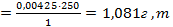 Na2CO3 = 1,081г
Na2CO3 = 1,081г
Пример 2. При титровании навески NaOH массой 0,1102 г (растворенной в произвольном количестве воды) израсходовано 24 мл раствора соляной кислоты. Рассчитайте Сэкв и титр НСl.
Решение: определить число моль - эквивалентов NaOH в навеске по формуле:
nэкв = 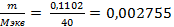 моль-экв.
моль-экв.
Мэкв(NaOH) =  = 40г/моль-экв
= 40г/моль-экв
В точке эквивалентности (в момент окончания реакции) n экв1 =n экв2, то есть 0,002755 моль-экв. (NaOH)= 0,002755 моль - экв. (НCl).
Далее рассчитываем эквивалентную концентрацию и титр раствора соляной кислоты:
Сэкв·V = nэкв
Сэкв(HCl) = 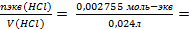 0,1148 моль-экв/л
0,1148 моль-экв/л
Cэкв(HCl)= 0,1148н
T (HCl) 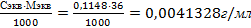
T (HCl) = 0,0041328г/мл
Пример 3. Сколько граммов гидроксида натрия было в растворе, если на нейтрализацию этого раствора израсходовано 10 мл соляной кислоты, эквивалентная концентрация которого 0,1024 н?
Решение. Зная объем раствора соляной кислоты (10 мл = 0,01л) и эквивалентную концентрацию этого раствора, рассчитываем, сколько моль-экв. соляной кислоты вступило в реакцию:
nэкв = Сэкв · V
пэкв(НС1) = 0,1024· 0,01 = 0,001024 молъ-экв.
В точке эквивалентности nэкв1=nэкв2
т.е. 0,001024моль-экв. (НС1)= 0,001024моль-экв.(NaOH).
Итак, в растворе было 0,001024 моль-экв. NaOH. Чтобы определить массу NaOH в растворе, можно воспользоваться формулой т = nэкв • Мэкв
т NaOH = 0,001024ž 40= 0,04096 г
Мэкв(NaOH) = 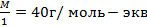 .
.
3.2.1. Метод нейтрализации
В основе метода нейтрализации лежит реакция взаимодействия катионов Н+ с анионами ОН -с образованием слабодиссоциирующих молекул воды:
Н+ + ОН- = Н2О
Этот метод применяется для количественного определения кислот (HCI, HBr, HNO3, H2SO4, H3PO4, CH3COOH и др.), щелочей (КОН, NaOH, Ва(ОН)2 и др.), солей, способных гидролизоваться в водных растворах (Na2CO3, Na2B4O7, NH4CI и др.). В методе нейтрализации необходимо использовать индикаторы, так как в их отсутствии реакция идет без внешнего эффекта, и определить момент окончания реакции невозможно.
Различают следующие случаи титрования.
1. Титрование сильной кислоты сильным основанием (или наоборот):
НС1 + NaOH = NaCl + Н2О
Н+ +ОН- = Н2О
|
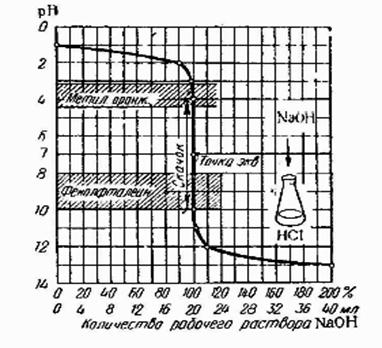
В момент окончания реакции (в точке эквивалентности) рН=7, среда нейтральная, так как соль NaCl гидролизу не подвергается.
2. Титрование слабой кислоты сильным основанием (или наоборот):
СН3 СООН + NaOH = CH 3COONa + Н2О
СН 3СООН+ОН- = СН 3СОО- + Н2О
Образующаяся соль - ацетат натрия - подвергается гидролизу:
СН 3СООNa + Н2O <=> СН 3СООН + NaОН
CH3COO- + HOH<=>CH3COOH + OH-
|
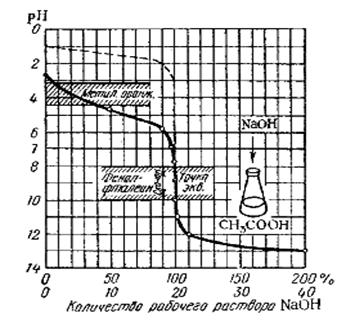
В растворе появляется избыток ионов ОН-, поэтому в момент окончания реакции среда раствора щелочная рН >7.
3. Титрование слабого основания сильной кислотой (или наоборот):
NH4OH + HCl=NH4Cl+H2O
NH4OH + Н+ = NH4+ + Н2О
Образующаяся соль - хлорид аммония - тоже гидролизуется.
NH4 Cl + H2O<=> NH4OH + HCl
NH4+ + НОН <=>NH4OH + Н+
|

В растворе накапливаются ионы H+, поэтому в точке эквивалентности среда раствора кислая, рН < 7.
Из всего следует, что природа реагирующих кислот и оснований оказывает непосредственное влияние на величину рН раствора в точке эквивалентности, и пользоваться во всех случаях одним и тем же индикатором нельзя.
Необходимые данные для важнейших индикаторов, применяемых в методе нейтрализации, приведены в приложении, табл. 4.
При титровании сильной кислоты сильным основанием (или наоборот) можно применить все индикаторы. При титровании слабой кислоты сильным основанием (или наоборот) применяют фенолфталеин. При титровании слабого основания сильной кислотой (или наоборот) применяют метилоранж, метилрот. Титрование слабой кислоты слабым основанием (или наоборот) не дает достоверных результатов, так как ни один из индикаторов резко свою окраску не изменяет, определить момент окончания реакции невозможно.
Вопросы для выполнения контрольной работы
61. Сущность метода нейтрализации. Сколько граммов гидроксида кальция требуется на нейтрализацию 0,5 моль-экв кислоты?
62. Объемный (титриметрический) анализ: сущность анализа, общая характеристика, условия, необходимые для его реализации. Классификация методов объемного анализа.
63. Метод нейтрализации. Общая характеристика метода. Рабочие растворы. Точка эквивалентности, определение ее в данном методе. Определите среду раствора и величину рН в точке эквивалентности при титровании уксусной кислоты гидроксидом натрия. Укажите индикатор, который используют для установления точки эквивалентности в данном случае. Составьте соответствующие уравнения реакций.
64. Рассчитайте массу гидроксида калия в растворе, если на его титрование израсходовано 15,4 мл серной кислоты с титром = 0,002656 г/мл.
65. Что такое индикаторы? Какие индикаторы применяются при определениях методом нейтрализации? Что такое область перехода индикатора? Какую окраску имеет метилоранж при рН ≤ 3,1; при рН ≥ 4,4? В каком случае титрования можно применять данный индикатор?
66. Типичные случаи титрования в методе нейтрализации. Сколько граммов гидроксида бария было в растворе, если на нейтрализацию этого раствора израсходовано 25 мл 0.8н раствора НCl?
67. Что такое молярная концентрация, молярная концентрация эквивалентов и титр раствора? Рассчитайте молярную концентрацию, молярную концентрацию эквивалентов и титр раствора ортофосфорной кислоты, если в 3-х л его содержится 19,6 г ее.
68. Суть закона эквивалентов. Закон эквивалентов для реагирующих растворов. Определите объем 0,5н раствора серной кислоты, необходимый для нейтрализации 150 мл 0,1н раствора гидроксида калия.
69. Какие растворы называются стандартными, стандартизированными? Что такое титрование, способы титрования, эквивалентная точка титрования? Фиксирование точки эквивалентности в различных методах титриметрического анализа. Приведите примеры.
70. На титрование 25 мл раствора хлорида калия затрачен 22 мл раствора нитрата серебра с титром 0,003588 г/мл. Определите массу хлорид - ионов в растворе.
71. Опишите основные случаи титрования в методе нейтрализации. Что такое кривые титрования, как их получают? Как, используя кривую титрования, правильно выбрать индикатор? Определите эквивалентную концентрацию и титр раствора серной кислоты, если известно, что на нейтрализацию 0,09 моль-экв щелочи при титровании было израсходовано 20 мл раствора этой кислоты.
72. В чем заключается сущность ионной теории индикаторов? Области перехода важнейших рН - индикаторов. Выбор индикатора в методе нейтрализации. Диссоциацию индикатора можно выразить уравнением:
HJnd(красный) ↔ H+ + Jnd- (синий)
Определите окраску индикатора в нейтральной, кислой и щелочной среде.
73. В мерную колбу емкостью 100 мл перенесли и растворили в воде 0,6504 г технической щавелевой кислоты. На титрование10 мл полученного раствора пошло 9,85 мл 0,1026н раствора гидроксида натрия. Определите массовую долю (%) H2C2O4∙ 2H2O в технической щавелевой кислоте.
74. Что является рабочими растворами в методе нейтрализации? Способы их приготовления. Укажите, какую из перечисленных солей можно использовать в методе нейтрализации: Na2SO4, Ca(NO3)2, K2CO3. Объясните правильность выбора. Напишите уравнение гидролиза этой соли, укажите характер среды раствора данной соли и рабочий раствор для ее титрования.
75. Вычисления в объемном анализе. Вычисления, связанные с приготовлением и разбавлением растворов. Вычислить молярную концентрацию, молярную концентрацию эквивалентов и титр 16% раствора фосфорной кислоты плотностью 1,1 г/мл.
76. Образец технического оксида магния массой 0,1535 г растворили в 40 мл соляной кислоты с титром = 0,003646 г/мл. Избыток соляной кислоты оттитровали 5,5 мл раствора гидроксида натрия с титром = 0,00404 г/мл. Вычислите массовую долю оксида магния в образце.
77. Рассчитайте, сколько концентрированной соляной кислоты плотностью 1,19 г/мл надо взять для приготовления 1 литра 0,1н раствора. Определите титр данного раствора.
78. Опишите один из возможных случаев титрования в методе нейтрализации – титрование сильной кислоты сильным основанием. Чему равен скачок на кривой титрования в данном случае? Какой индикатор можно применить для установления точки эквивалентности и почему? Определите массу гидроксида натрия в растворе, если на его титрование израсходовано 30 мл раствора соляной кислоты, с титром 0,003646 г/мл?
79. На основе какого закона проводятся вычисления в титриметрических методах анализа? Приведите формулировку и различные математические выражения его. Рассчитайте молярную концентрацию эквивалента и титр раствора гидроксида бария, если на титрование 10,5 мл его израсходовано 12,5 мл раствора азотной кислоты.
80. Теория индикаторов. Что такое область перехода индикатора? Диссоциацию индикатора можно выразить уравнением:
JndOH ↔ Jnd+ + OH-
(синий) (желтый)
Определите окраску индикатора в нейтральной, кислой и щелочной среде, основываясь на принципе Ле Шателье.
3.2.2. Оксидиметрические методы объемного анализа
В основе этих методов лежат окислительно-восстановительные реакции. По видам рабочих растворов, применяемых для анализа, последние делятся на:
а) перманганатометрию (раствор KMnO4 в кислой среде);
б) хроматометрию (раствор К2Сr2О7 в щелочной среде);
в) йодометрию (раствор KI или I2 в нейтральной среде) и др.
Метод перманганатометрии
Перманганатометрией называют метод титриметрического анализа, при котором рабочим раствором служит раствор перманганата калия. Перманганат калия проявляет окислительные свойства в кислой, щелочной и нейтральной среде. В кислой среде Мn+7, входящий в состав КМпО4, восстанавливает до бесцветных катионов Мn+2. Например:
2KMnO4 + 3H2SO4 + 5Na2SO3 = 2MnSO4 + 5Na2SO4 +3 H2О
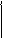

 Mn+7 + 5e-→ Mn+2 5 2
Mn+7 + 5e-→ Mn+2 5 2
S+4 – 2e- → S+6 2 5
M(KMnO4) = 158 г/моль
Мэкв(KMnO4) = 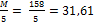 г/моль-экв.
г/моль-экв.
При титровании в нейтральной среде Мп+7 восстанавливается до Мп+4 (обычно до МпО2, представляющего собой осадок бурого цвета):
2KMnO4 + 2H2O + 3Na2SO3 = 2MnO2↓ + 3Na2SO4 + 2KOH

 Mn+7 + 3e- → Mn+4 3 2
Mn+7 + 3e- → Mn+4 3 2
S+4 – 2e- → S+6 2 3
Мэкв (KMnO4) =  52,67 г/моль-экв.
52,67 г/моль-экв.
При титровании в щелочной среде п+7 восстанавливается до (Мп+604)-2, который окрашивает раствор в зеленый цвет:
2KMnO4 + 2КОН+ Na2SO3 = 2К2МпО4 + Na2SO4 + Н2О

 Mn+7 + 1e- → Mn+6 1 2
Mn+7 + 1e- → Mn+6 1 2
S+4 – 2e- → S+6 2 1
Мэкв(KMnO4) = 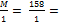 52,67 г/моль-экв.
52,67 г/моль-экв.
Ион (Мп+6 О 4)-2 очень быстро восстанавливается до МпО2:
3KMnO4+ 2Н2О= MnO2↓ + 2KMnO4 + 4KOH
То есть при окислении в нейтральной и щелочной среде в конечном итоге образуется бурый осадок МпО2.
Схематически процесс окисления КМпО4 в кислой, нейтральной и щелочной среде можно изобразить следующим образом:
 KMn+7O4 раствор H+ + 5e- Mn2+ бесцветный раствор
KMn+7O4 раствор H+ + 5e- Mn2+ бесцветный раствор
 малиново-фиолетовый H2O+3e- Mn+4 O2 бурый осадок
малиново-фиолетовый H2O+3e- Mn+4 O2 бурый осадок
 OH- + 1e- KMn+6O4 зеленый раствор
OH- + 1e- KMn+6O4 зеленый раствор
Особенности метода
1. Перманганатометрия проводится в кислой среде, так как окислительные свойства КМпО4 в кислой среде гораздо выше, чем в щелочной и нейтральной. Кроме этого, только в кислой среде в результате реакции образуются бесцветные ионы Мn2+. При окислении в щелочной и нейтральной среде выпадает осадок МпО2, сильно затрудняющий фиксирование момента окончания реакции.
2. В перманганатометрии не применяются индикаторы, так как в точке эквивалентности 1 избыточная капля приливаемого перманганата вызывает появление розовой окраски. Таким образом, индикатором является сам раствор КМпО4.
3. Перманганат калия под действием света буреет.
Вопросы для выполнения контрольной работы
81. Классификация оксидиметрических методов анализа. Реакции, лежащие в основе метода? Уравняйте реакцию методом электронного баланса и рассчитайте молярные массы эквивалентов окислителя и восстановителя:
KMnO4 + Cr2(SO4)3 + KOH = K2CrO4 + MnO2 + K2SO4 + H2O
82. На окисление 25 мл 0,02н раствора соли Мора требуется 40 мл раствора перманганата калия. Определите эквивалентную концентрацию и титр раствора перманганата калия.
83. Метод перманганатометрии, особенности метода. При титровании соли Мора перманганатом калия протекает реакция:
FeSO4 + KMnO4 + H2SO4 = MnSO4 + Fe2(SO4)3 +K2SO4 + H2O
Уравняйте реакцию с помощью метода электронного баланса и рассчитайте молярные массы эквивалентов окислителя и восстановителя.
84. Составьте уравнения реакций между перманганатом калия и сульфитом натрия в кислой, щелочной и нейтральной среде и рассчитайте молярные массы эквивалентов окислителя и восстановителя.
85. Какой объем 0,02н раствора перманганата калия требуется для окисления 0,1 моль-экв соли Мора? Составьте уравнение реакции, протекающей при данном случае титрования.
86. Составьте уравнение реакции взаимодействия перманганата калия с сульфатом железа(II) в сернокислом растворе и рассчитайте, сколько граммов перманганата калия потребуется для окисления 20 г сульфата железа(II) в данных условиях.
87. Сколько граммов перманганата калия потребуется на окисление 0,3 моль-экв щавелевой кислоты в кислой среде? Составьте уравнение данной реакции и рассчитайте молярные массы эквивалентов окислителя и восстановителя.
88. Рассчитайте молярную концентрацию эквивалентов раствора перманганата калия и титр перманганата калия по железу, если на титрование навески 0,1228 г химически чистой щавелевой кислоты H2C2O4∙ 2H2O расходуется 30,0 мл раствора перманганата калия.
89. Рассчитайте молярную концентрацию эквивалентов рабочего раствора перманганата калия и его титр, если на титрование 10 мл этого раствора израсходовано 9,5 мл 0,1514н раствора щавелевой кислоты.
90. Закончите уравнение реакции, уравняйте его с помощью метода электронного баланса и рассчитайте молярные массы эквивалентов окислителя и восстановителя:
K2Cr2O7 + H2SO4 + NaNO2 =
91. Составьте уравнение реакции между йодом и тиосульфатом натрия, уравняйте методом электронного баланса. Рассчитайте молярные массы эквивалентов окислителя и восстановителя.
92. Навеска 2,440 г технического сульфита натрия растворена в мерной колбе емкостью 250 мл. К 25 мл этого раствора добавили 50 мл 0,1н раствора йода, избыток которого оттитровали 30 мл 0,1н раствора тиосульфата натрия. Найдите массовую долю сульфита натрия в образце.
93. Определите молярную концентрацию эквивалентов раствора йода и его титр, если на титрование 23 мл йода пошло 10,67 мл 0,056н раствора тиосульфата натрия. Составьте соответствующее уравнение реакции. К какому методу титрования относится данный способ? В чем его особенности?
94. Опишите, как проводятся количественные определения хроматометрическим методом? К какой группе методов он относится? Закончите уравнение реакции, уравняйте его методом электронного баланса и рассчитайте молярную массу эквивалентов окислителя и восстановителя:
K2CrO4 +HCl = Cl2 + CrCl3 + KCl + H2O
95. Определите молярную концентрацию эквивалентов и титр раствора перманганата калия, если 38,5 г перманганата калия растворили в колбе и довели объем до 250 мл (среда кислая).
96. Какой объем 0,02 н раствора перманганата калия достаточен для окисления 0,112 г железа, содержащегося в соли Мора?
97. Составьте уравнение реакции, протекающей при титровании соли Мора перманганатом калия. Уравняйте ее методом электронного баланса и рассчитайте молярные массы окислителя и восстановителя. К какому методу оксидиметрического анализа относится данный способ титрования?
98. Рассчитайте молярную концентрацию эквивалентов перекиси водорода, если на титрование 9.5 мл раствора израсходовано 15 мл 0,13н раствора KMnO4. Составьте соответствующее уравнение реакции.
99. Рассчитайте молярную концентрацию эквивалентов и титр перманганата калия, если на титрование 0,1 моль-экв раствора щавелевой кислоты израсходовано 15 мл раствора KMnO4. Составьте уравнение соответствующей реакции.
100. Метод йодометрии. Особенности метода. Определите, какой объем 5% раствора можно приготовить из 10г кристаллического йода. Плотность раствора 0,950 г/мл.
3.2.3. Осадительное титрование
Методы осаждения обусловлены реакциями образования малорастворимых веществ, выпадающих в осадок. Конечный момент реакции определяется большей частью посредством индикаторов, которые в эквивалентной точке вступают в соединение с рабочим раствором с образованием какого-либо характерного признака. Методы могут быть прямыми и непрямыми, т.к. осадитель может быть прибавляем до тех пор, пока не прекратится образование осадка, или же может быть прибавлен избыток его и количество избытка осадителя определено затем титрованием. В качестве рабочего раствора применяется чаше всего нитрат серебра, по которому и называют метод аргентометрическим. На основе аргентометрии производят определение ионов галогенов в их солях.
При применении прямого титрования (метод Мора) галоиды осаждают в виде AgГ, индикатором же служит раствор хромата натрия (K2CrO4), который в момент завершения реакции дает с ионами серебра окрашенный осадок состава Ag2CrO4.
Ag+ + Г- = AgГ
2Ag+ + K2CrO4= Ag2CrO4 + 2K+
Метод Мора применим в нейтральной или слабощелочной среде (рН 7-10), т.к. в кислой и щелочной среде происходит разрушение Ag2CrO4 c образованием H2CrO4 и Ag2O. Препятствует использованию метода присутствие в растворе других катионов, таких как Ba2+, Pb2+ и др.
При непрямом методе титрования (метод Фольгарда) к исследуемому раствору приливают избыток нитрата серебра и остаток его оттитровывают роданидом аммония в присутствии индикатора железо-аммонийных квасцов NH4Fe(SO4)2, которые в эквивалентной точке дают розовое окрашивание, вызываемое появлением Fe(CNS)3.
При определении галогенов по данному методу имеют место следующие реакции:
Ag+(избыток) + Г- = AgГ+ Ag+(остаток)
Ag+(остаток) + CNS- = AgCNS
Fe2(SO4)3 + 6NH4CNS=2Fe(CNS)3+3(NH4)2SO4
Вопросы для выполнения контрольной работы
101. Характеристика осадительного титрования. В чем сущность метода Мора? Какие реакции лежат в основе метода? На титрование раствора NaCl расходуется 30 мл раствора AgNO3 с титром по хлору 0,003512 г/мл. Определите количество хлорид - ионов в титруемом растворе.
102. Какие вещества можно анализировать методом аргентометрии? В чем сущность данного метода? Сколько граммов нитрата серебра потребуется для осаждения навески хлорида калия массой 7.45 г?
103. Как устанавливается точка эквивалентности в методе Мора? Составьте уравнения протекающих при этом реакций. Какой объем 0,1н раствора соляной кислоты потребуется для осаждения серебра из навески нитрата серебра массой 0,6 г?
104. Требования к реакциям, используемым в методе осаждения. Сколько мл 0,15н раствора соляной кислоты потребуется для осаждения серебра из навески нитрата серебра массой 0,6 грамма.
105. Сущность метода Фольгарда. Рабочий раствор метода, как устанавливается точка эквивалентности в данном методе. Составьте уравнения соответствующих реакций. Сколько граммов роданида аммония необходимо взять, чтобы приготовить 1 л 0,05н раствора?
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 6251; Нарушение авторских прав?; Мы поможем в написании вашей работы!