
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесный электродный потенциал
|
|
|
|
Погрузим инертный металл (Pt) в электролит, содержащий Ox/Red пару.
Обмен электронами между окислителем и восстановителем
Ox + ne = Red
протекает с участием платинового электрода (рис. 5)
Ox + ne(Pt)= Red + Pt
 Pt
Pt
раствор
+
 анодный процесс Red - nе = Ox
анодный процесс Red - nе = Ox
 катодный процесс Ox + ne = Red
катодный процесс Ox + ne = Red
Рис. 5. Схема анодного и катодного процессов, протекающих на Pt электроде (направление стрелок указывает направление движения электронов).
Неравенство скоростей прямой и обратной реакции приводит к изменению концентрации электронов в металле, а значит и к изменению потенциала электрода. Когда скорости прямой и обратной реакции становятся равными, в системе устанавливается электрохимическое равновесие. Электродный потенциал, отвечающий этому равновесию, называется равновесным электродным потенциалом.
Для любой электродной реакции вида
aA + bB +...+ qQ + ne = a'A' + b'B' +...+ q'Q'
равновесный электродный потенциал определяется уравнением Нернста
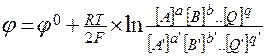
где R-газовая постоянная (8.31 в системе единиц Си), Т - абсолютная температура, n-число электронов для окислительно-восстановительной реакции, F-число Фарадея (96500 кулонов), j0-стандартный равновесный потенциал, т.е. потенциал при активностях окисленной и восстановленной форм, равных 1. Если одно из веществ является газообразным, то вместо концентрации в уравнении Нернста подставляется парциальное давление газа.
В частности, для более простой окислительно-восстановительной реакции вида
Ox + ne = Red
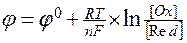
где через [Ox],[Red] обозначены концентрации (или активности) окисленной и восстановленной форм веществ. В уравнении Нернста окисленная форма вещества всегда стоит в числителе. Как видно из этого уравнения, при изменении концентраций окислителя (или восстановителя) должно происходить и изменение равновесного потенциала электрода. Из него следует, что с увеличением концентрации окисленной формы равновесный потенциал электрода должен смещаться в положительную сторону. А при увеличении концентрации восстановленной формы равновесный потенциал смещается в отрицательную сторону.
В частности, для окислительно- восстановительной реакции выделения-ионизации водорода на платине
2H+ + 2e = H2
равновесный потенциал определяется уравнением Нернста вида

Такой электрод называется водородным. Для стандартных условий, т.е.
когда активность ионов водорода и парциальное давление водорода равны
1, а температура 250 С, по всеобщему соглашению принимается, что стан-
дартный потенциал водородного электрода равен нулю. Водородный элект-
род называют электродом сравнения.
Составим следующую электрохимическую цепь с водородным электродом сравнения
Pt÷ Ox, Red ÷÷ Н+, H2÷ Pt
Измеряя разность потенциалов на концах этой цепи в стандартных услови-
ях, т.е. когда активности всех веществ равны единице, получаем стан-
дартный потенциал исследуемой окислительно-восстановительной реакции.
Стандартные электродные потенциалы (j0) для множества окислительно-восстановительных реакций приведены в справочниках. Все эти величины даны относительно нормального водородного электрода.
На основании этих данных можно построить шкалу потенциалов, на
которой каждой окислительно-восстановительной электрохимической реак-
ции соответствует свое значение стандартного потенциала.
j0, В
 3.06 F2 + 2H+ + 2e = 2HF - самое положительное значение
3.06 F2 + 2H+ + 2e = 2HF - самое положительное значение
стандартного потенциала
0 2H+ + 2e = H2 - условный нуль потенциала
-3.024 Li+ + e = Li - самое отрицательное значение
стандартного потенциала
Таким образом, стандартные потенциалы множества электрохимических реакций заключены приблизительно в пределах от -3 до +3 вольт.
Одноэлектродные цепи.
К ним можно отнести:
"Металлический" электрод 1-го рода (металл граничит непосредственно с раствором собственных ионов).
Для окислительно-восстановительной реакции типа
Ме = Меn+ + ne
уравнение Нернста принимает вид
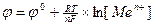
Все металлы, стоящие в ряду напряжений левее водорода, имеют отрицательный стандартный потенциал, и способны вытеснять водород из растворов кислот, а все металлы, стоящие правее водорода, соответственно положительный стандартный потенциал и водород из растворов кислот вытеснять не могут.
"Металлический" электрод 2-го рода (металл граничит с электролитом через слой малорастворимого соединения этого металла: оксида, гидроксида или труднорастворимой соли-МХ). Схематически металлический электрод 2-го рода можно представить таким образом
Ме|МеХ| р-р
Электроды сравнения.
Хлорсеребряный электрод.
Малая растворимость хлористого серебра позволяет построить удобный в использовании электрод сравнения, который схематически можно изобразить так (металлический электрод 2-го рода)
AgôAgClô Cl-
Он имеет равновесный потенциал, который зависит от концентрации ионов хлора. В насыщенном растворе хлорида калия равновесный потенциал хлорсеребряного электрода равен 0.2 В и неограниченно долго сохраняет свое постоянное значение.
Двухэлектродная цепь для измерения потенциала электрода.
Составим двухэлектродную электрохимическую цепь из рабочего
электрода (Ме) и постоянного электрода сравнения (Э.С.).
Мeô p-p ôô Э.С.
Электрод сравнения здесь служит для измерения разности потенциалов между рабочим электродом и электродом сравнения. Поскольку потенциал электрода сравнения остается постоянным, то измеряемая с помощью вольтметра в этой цепи разность потенциалов с точностью до постоянной величины характеризует потенциал рабочего электрода. Если, например, при погружении исследуемого металла в рабочий раствор измеряемая разность потенциалов изменяется во времени, то это означает, что изменяется во времени только потенциал рабочего электрода. Измеряемый в такой цепи потенциал рабочего электрода является бестоковым потенциалом, поскольку между рабочим электродом и электродом сравнения ток не протекает. Если бестоковый потенциал рабочего электрода подчиняется уравнению Нернста, то такой потенциал называется равновесным (обратимым). В противном случае бестоковый потенциал называется неравновесным (или необратимым).
Трехэлектродная цепь.
Стандартную трехэлектродную электрохимическая цепь для проведения измерений на рабочем электроде при прохождении через него постоянного тока схематически можно изобразить таким образом
в.эôр-р 1 ôô р.э.ôp-p 2ôô э.с.
Источник постоянного тока в такой цепи подключают к рабочему и вспомогательному электродам. А для измерения потенциала рабочего электрода вольтметр подключают к рабочему электроду и электроду сравнения. Так проводят поляризационные измерения, при которых изучают зависимости плотности тока от потенциала электрода i=i(j) при различных условиях.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 5798; Нарушение авторских прав?; Мы поможем в написании вашей работы!