
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Питтингами
|
|
|
|
Язвами, нивающая транскристаллитная
О Б Щ А Я Л О К А Л Ь Н А Я
Э Л Е К Т Р О Х И М И Ч Е С К А Я К О Р Р О З И Я
Формы коррозионных разрушений.
По форме коррозионных разрушений коррозия делится на виды
 |  |
 |  |  |  |
равномерная неравномерная пятнами, раскли- межкристаллитная,
Для всех металлических изделий, испытывающих механическую нагрузку,наиболее опасными являются локальные виды коррозии. Это демонстрирует график зависимости потерь прочности детали из дуралимина от коррозионных потерь веса при различных видах коррозионного разрушения.
Потери прочности, %
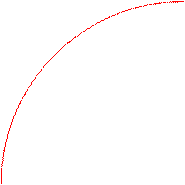
 межкристаллитная
межкристаллитная
80 коррозия
неравномерная
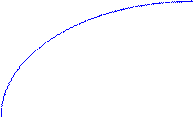 коррозия
коррозия
20 равномерная
 коррозия
коррозия
 0 Потери веса, мг/см2
0 Потери веса, мг/см2
При коррозии металла на его поверхности одновременно протекают две независимые электрохимические реакции
Me - ne = Men+ окисление (ионизация) металла
Ox + ne = Red восстановление окислителя среды
В стационарном состоянии все электроны, которые выделяются в результа-
те ионизации металла должны потребляться в сопряженном процессе восс-
тановления окислителя.
Если в качестве окислителя при коррозии металла выступают ионы
водорода, то такая коррозия называется коррозией с водородной деполя-
ризацией.
В этом случае при одном и том же стационарном потенциале одновременно протекают процессы растворения металла и восстановления ионов водорода
Me = Men+ + ne
2H+ + 2e = H2
Если в качестве окислителя при коррозии металла выступают молекулы растворенного кислорода, то такая коррозия называется коррозией с кислороднойдеполяризацией. В этом случае при одном и том же стационарном потенциале одновременно протекают процессы растворения металла
и восстановления молекул кислорода. Эти процессы для щелочных растворов имеют вид
Me = Men+ + ne
O2 + 2H2O + 4e = 4OH-
В кислых растворах восстановление кислорода протекает по схеме
О2 + 4H+ + 4e = 2H2O восстановление кислорода
В нейтральных средах для активных металлов, вытесняющих водород
из воды, в качестве восстановителя могут выступать сами молекулы воды
2H2O + 2e =H2 + 2OH-
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 426; Нарушение авторских прав?; Мы поможем в написании вашей работы!