
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция №12
|
|
|
|
NF
М
m= ¾ It
где M- молекулярный (или атомный) вес выделенного вещества, n-число
электронов в суммарном уравнении электрохимической реакции.
Опыт показал, что зависимость потенциала электрода от плотности тока описывается уравнением Тафеля
j = a + blg i
где a и b- постоянные. В координатах j - lg i поляризационная кривая (ПК) представляет собой прямую с наклоном b, который называют тафелевским наклоном.
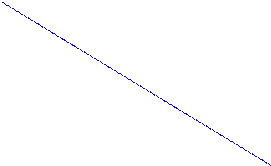
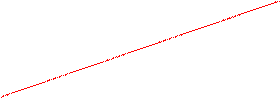
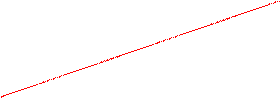
Таким образом, анодная и катодная ПК могут быть представлены парой прямых. Точка пересечения которых отвечает равновесному потенциалу электрода и току обмена реакции (рис. 1)
 j
j
 Red = Ox + ne - анодный процесс
Red = Ox + ne - анодный процесс
анодная поляризационная кривая
 jp
jp
Ox + ne = Red -катодный процесс
катодная поляризационная кривая

io lg i
Рис. 1. Схема поляризационных кривых (ПК).
Разность h = j- jр называют перенапряжением. Уравнение Тафеля чаще записывают не через потенциала, а через перенапряжение
h= а + blg i
В электролизере на электродах одновременно протекают две независимые электрохимические реакции
Ox1 + ne = Red1
Red2 = Ox2 + ne
и для каждой из этих реакций теоретически можно построить свою па-
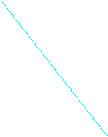
ру анодных и катодных ветвей поляризационных кривых (cм. ниже рис. 2)

 j
j
Red1 = Ox1 + ne
jр(Ox1/Red1)
Ox1 + ne = Red2

jр(Ox2/Red2) Red2 = Ox2 + ne



Ox2 + ne = Red2
 |
lg i
Рис.2 Схема поляризационных кривых для двух независимых реакций электролизера
.
Каждой из этих реакций отвечает свой равновесный потенциал, который определяется уравнением Нернста. Их разность определяет так называемое напряжение разложения
Uразлож.= jр(Ox1/Red1) - jр(Ox2/Red2)
т.е. минимальное напряжение, которое необходимо приложить к электролизеру от внешнего источника тока, для того чтобы мог начаться процесс электролиза.
Электролизом раствора хлорида натрия в промышленности получают газообразный хлор и щелочь. На аноде протекает реакция окисления хлорид ионов с образованием газообразного хлора
2Сl- = Cl2 + 2e анодный процесс
а на катоде восстановление воды с образованием щелочи и выделением водорода
2H2О + 2e = Н2 + 2OH- катодный процесс
Электролизом соединений алюминия в промышленности получают алюминий. Аналогичным образом получают и магний.
В технологии используется также электрохимическая размерная обработка. Сущность такой обработки состоит в том, что деталь подключается к положительному полюсу источника тока, а обрабатывающий инструмент - к отрицательному. В зазор между деталью и инструментом с большой скоростью пропускают раствор электролита, что обеспечивает анодное растворение металла заготовки и вынос продуктов растворения. Электрохимическая размерная обработка позволяет провести обработку деталей из материалов, трудно обрабатываемых механическими способами, или деталей сложной формы.
Гальванические покрытия широко применяются в различных отраслях промышленности для защиты изделий от коррозии, увеличения срока службы и придания им красивого декоративного вида. В технологии широко используются такие процессы нанесения гальванических покрытий, как цинкование, кадмирование, меднение, никелирование, хромирование, лужение, серебрение, золочение, электролитическое осаждение сплавов..
Анодирование- получение оксидов на поверхности металлов и полупроводников при анодной поляризации в кислородсодержащих средах с ионной проводимостью.
За счет образования анодного оксида изменяются поверхностные свойства материала: твердость, электрическое сопротивление, термостойкость, изностойкость, каталитическая активность и др.
Широко распространена технология анодирования алюминия, титана, тантала, ниобия, кремния, германия, арсенида галлия.
В зависимости от вида кислородсодержащей среды, заполняющей межэлектродное пространство, различают анодирование: в водных растворах электролитов, в расплавах солей, в газовой плазме, плазменно-электролитическое.
Анодирование в водных растворах электролитов наиболее распространенный и универсальный способ, легко поддающийся автоматизации. Площадь одновременно анодируемых в ванне изделий определяется только вместимостью ванны и мощностью источника тока и достигает 100 м2 и более. В качестве электролитов применяют водные растворы кислот или щелочей. Основное назначение оксидов, полученных этим методом, -защита металлических изделий от коррозии, декоративная отделка, упрочнение поверхности, применение в качестве диэлектрика конденсаторов, основы для фотографического слоя, полупроводниковых переходов, подслоя для лаков и красок и др.
В электролитах борной кислоты, буры, нитратов, фосфатов, бикарбонатов получают тонкие (до 1 мкм) плотные оксиды.
В электролитах кислот хромовой, серной, щавелевой, фосфорной, а также сульфатов получают оксиды до 250 мкм. Эти оксиды имеют двухслойную структуру: тонкий, прилегающий к металлу слой имеет плотную упаковку; наружный слой-пористый.
В растворах хлорида или фторида анодный оксид не возникает; происходит травление металлов.
Для получения оксидов толщиной 150-250 мкм обычно требуется охлаждение электролита и изделия.
Цветостойкие покрытия получают:
- анодированием в двух- и трехкомпонентных электролитах, содержащих ароматические сульфокислоты и серную кислоту;
- в растворах неорганических солей реакций двойного обмена-осаждением в порах оксида цветного неорганического соединения;
- в растворах неорганических солей с использованием переменного тока.
Непрозрачные защитно-декоративные эмаль-покрытия имеют толщину в несколько десятков мкм, обладают высокой твердостью и хорошей адгезией. Их получают в электролитах на основе хромовой и щавелевой кислот и их солей.
Установка для анодирования представляет собой ванну, заполненную электролитом, в которую помещены два электрода: катод и окисляемое изделие-анод.
Наиболее распространенный электролит при анодировании алюминия - водный раствор серной кислоты. Катод выполняют из свинца, графита или коррозионно-стойкой стали. Часто применяемый режим толстослойного анодирования: концентрация серной кислоты 200 г/л; плотность тока 2.5-5 А/м2; напряжение 15-120 В; температура электролита -4-40С; продолжительность анодирования 240 мин; толщина покрытия до 175 мкм.
В радиоэлектронной промышленности анодирование в водных растворах электролитов применяется при производстве конденсаторов.
Анодирование в расплавах солей применяют для получения оксидов повышенной толщины и микротвердости, в частности, на меди и железе. В качестве электролита используют расплавы солей с температурой до 4000С. Это метод применяют для создания диэлектрика высоковольтных конденсаторов и электроизоляционных покрытий.
Анодирование в газовой плазме. Различают анодирование в плазме тлеющего разряда постоянного тока и в плазме высокочастотного разряда. Анодирование ведут под колпаком вакуумной установки при пониженном давлении. На два электрода, служащие для разряда, подают напряжение 500-1500 В. Анодирование в газовой плазме ведут в среде кислорода или атмосферного воздуха, обычно при давлении 1-100 Па. Максимальная толщина окислов достигает 800 нм. Анодирование в газовой плазме широко применяют в микроэлектронике.
Плазменно-электролитическое анодирование имеет особенности, заключающиеся в том, что окисляемый образец - анод помещают в электролит, а катод размещают над анодом выше уровня электролита. Этот способ является промежуточным между анодированием в водных растворах электролитов и плазменным анодированием.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 686; Нарушение авторских прав?; Мы поможем в написании вашей работы!