
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретическая часть. Все биологические процессы протекают во времени
|
|
|
|
ТЕМА 1. КИНЕТИКА БИОЛОГИЧЕСКИХ ПРОЦЕССОВ.
Все биологические процессы протекают во времени. Для описания и оценивания этого удобной количественной характеристикой является скорость реакции или скорость процесса. Знание механизмов реакций и процессов, обеспечивающих их протекание с той или иной скоростью, зависимость скорости от различных факторов (концентрации веществ, температуры, рН, наличия катализаторов-ферментов, активаторов, ингибиторов и т.д.) позволяет прогнозировать развитие реакций или процессов, оптимизировать их протекание в нужном направлении и с необходимым результатом.
Представим химическое превращение в виде простой реакции:

Скоростью этой химической реакции будет величина накопления продукта в единицу времени
 ;
;
Кинетика базируется на фундаментальном положении Гулдберга-Вааге, согласно которому скорость реакции пропорциональна произведению концентраций реагирующих веществ в степенях, соответствующих их стехиометрическим коэффициентам. Это положение, связывающее активные концентрации веществ со скоростью реакции, так же известно как закон действующих масс. В соответствие с этим законом скорость реакции может быть выражена в следующем виде:
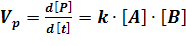
где к – коэффициент пропорциональности, называемый константа скорости реакции.
Рассмотрим вариант простейшей реакции 1 -го порядка, когда Скорость реакции в этом случае можно выразить как 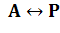
Знак минус на расходование реагента в ходе реакции.
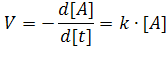
Пусть в начальный момент времени t=0 концентрация вещества А равна [А]0. После начала реакции начнется постепенное расходование реагента А и к моменту времени t = t его концентрация станет [А]. Используя эти граничные условия, проинтегрируем уравнение скоростей, предварительно разделим переменные
 ;
;
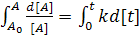 ;
;  ;
;
Отсюда или  или
или 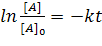 ;
;
Из этого уравнения после потенцирования выражение для зависимости| изменения концентрации вещества от времени 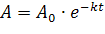
При переходе к десятичным логарифмам получается  ;
;
Отсюда определяется константа скорости  , где [А]0 и [А] - начальная и конечная концентрации вещества А.
, где [А]0 и [А] - начальная и конечная концентрации вещества А.
Помимо зависимости от концентрации реагентов скорость реакции существенно зависит от температуры. Известно эмпирическое правило, называемое законом Вант-Гоффа, согласно которому при повышении температуры на 10° скорость реакции возрастает приблизительно в 2 раза. Отношение констант скоростей реакции при двух температурах, различающихся на 10°, называется температурным коэффициентом 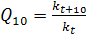 .
.
Правило Вант-Гоффа приближенное, поскольку температурный коэффициент Q10 меняется с температурой. Более точная зависимости скорости реакции (константы скорости) от температуры выражается уравнением Аррениуса, которое учитывает кинетическую энергию реагентов, определяющих характер влияния на скорость реакции:  , где А — предэкспоненциальный множитель, Т — абсолютная температура (К), R — универсальная газовая постоянная (1.98•10-3 ккал/М•градус), Еа - энергия активации. Она характеризует величиной энергетического потенциального барьера, который молекулы реагентов должны преодолеть для взаимодействия.
, где А — предэкспоненциальный множитель, Т — абсолютная температура (К), R — универсальная газовая постоянная (1.98•10-3 ккал/М•градус), Еа - энергия активации. Она характеризует величиной энергетического потенциального барьера, который молекулы реагентов должны преодолеть для взаимодействия.
Для любого температурного интервала Q10 вычисляется по формуле Вант-Гоффа:  , где К1 и К2 константы скорости реакции при температурах t1 и t2 соответственно.
, где К1 и К2 константы скорости реакции при температурах t1 и t2 соответственно.
Очевидно при t2 = t1 + 10,  ;
;  (пpи
(пpи 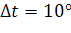 )
)
При изучении биологических процессов вычисление К обычно затруднительно и ее заменяют непосредственно величиной скорость процесса. Энергия активации, т.е. температурная характеристика процесса выводится из уравнения Аррениуса для скорости химической реакции:
 , где Ea - энергия активации.
, где Ea - энергия активации.
Из уравнения следует:  .
.
Формула устанавливает простое соотношение между Еа и Q10. Действительно, при T2-T1=10 и при переходе от ln к lg путем умножения на модуль 2,3 имеем: 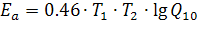 [кал/град•моль].
[кал/град•моль].
Энергия активации связана с температурным коэффициентом эмпирическим соотношением: 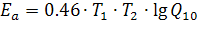
Прологарифмировав интегральное уравнение Аррениуса, получим выражение, удобное для определения величины энергии активации из экспериментально полученных величин: 
Из этого выражения следует, что  (или
(или 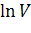 ) линейно зависит от величины обратной температуры (1/Т) (рис.1.1). Это очень удобно для графического представления кинетических экспериментальных данных. Если по оси ординат откладывать значения
) линейно зависит от величины обратной температуры (1/Т) (рис.1.1). Это очень удобно для графического представления кинетических экспериментальных данных. Если по оси ординат откладывать значения  (или
(или 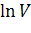 ), а по оси абсцисс -1/Т (координаты Аррениуса), то из наклона этого графика легко определяется величина энергии активации Еа.
), а по оси абсцисс -1/Т (координаты Аррениуса), то из наклона этого графика легко определяется величина энергии активации Еа.
 отсюда
отсюда 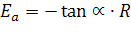 ;
;

Рис. 1.1. Диаграмма Аррениуса (представление экспериментальных данных в координатах Аррениуса).
Наиболее точно зависимость константы скорости реакции от температуры определяется на основе теории абсолютных скоростей реакций Эйринга. Эта зависимость выражается уравнением Эйринга:
 , где к0 - постоянная Больцмана 1.88*10-23 Дж/К; h - постоянная Планка 6.625*10-34 Дж*сек;
, где к0 - постоянная Больцмана 1.88*10-23 Дж/К; h - постоянная Планка 6.625*10-34 Дж*сек;  — изменение энтропии и энтальпии соответственно в результате химического превращения или процесса.
— изменение энтропии и энтальпии соответственно в результате химического превращения или процесса.

| Рис. 1.2. Примерный вид зависимости ЧСС от температуры. |
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 542; Нарушение авторских прав?; Мы поможем в написании вашей работы!