
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретическая часть. В начале третьего тысячелетия, когда отношения человека и природы стали просто опасными, особое значение приобретает экологическая грамотность
|
|
|
|
Лабораторная работа № 1
Введение
В начале третьего тысячелетия, когда отношения человека и природы стали просто опасными, особое значение приобретает экологическая грамотность, постижение каждым молодым человеком основ экологии и рационального природопользования. Если каждый человек будет представлять последствия от выкинутой им банки, разведённого костра, спиленного дерева, мир, несомненно, изменится к лучшему. Экология не просто наука об отношении организмов и условий среды. Она становится средством этического и патриотического воспитания, фундаментом нравственности. Она определяет отношения между ныне живущими людьми и гармонизирует отношения между поколениями, исходя из постулата, что жить за счёт детей и внуков и передавать им безнадёжно загрязнённую планету с исчерпанными ресурсами безнравственно. Поэтому для современной системы образования наряду с гуманизацией характерна экологизация.
Каждый студент должен знать: основные экологические законы, закономерности организации жизни, основы рациональной эксплуатации биологических ресурсов, основы сохранения среды обитания человека, о глобальных проблемах экологии и путях их решений, об основных методах защиты окружающей среды, об экономических и правовых аспектах природопользования.
Кроме того, каждый студент должен уметь: использовать экологические знания в профессиональной работе, анализировать экологическую обстановку местности, пользоваться основными правами и обязанностями экологического кодекса.
Освоению нового материала при изучении дисциплины «Экология» должны постоянно сопутствовать исследовательские работы учащихся. Неотъемлемой частью учебного процесса является проведение лабораторных занятий по отдельным разделам теоретического курса.
Настоящий лабораторный практикум включает восемь лабораторных работ. Включенные в сборник химические методы анализа широко используются в настоящее время в центрах Санэпиднадзора России, а тематика лабораторных работ максимально приближена к наиболее актуальным проблемам современности.
Определение жёсткости воды методом комплексонометрии.
Определение временной жёсткости воды методом титрования. Оценка качества питьевой воды по показателю жёсткости и установление степени риска её использования
Важнейшим показателем качества воды является жёсткость. Жёсткость воды - это совокупность свойств, обусловленных содержанием в ней катионов кальция и магния. Ввиду широкой распространенности кальция соли его почти всегда содержатся в природной воде. Один из возможных источников жёсткости - это растворившиеся при контакте с природной водой горные породы. Из природных солей кальция только гипс несколько растворим в воде, однако, если вода содержит диоксид углерода, то карбонат кальция тоже может переходить в раствор в виде гидрокарбоната Са(НСО3)2. Анионами растворимых солей кальция и магния могут быть гидрокарбонат-ионы, обусловливающие карбонатную жёсткость, и остатки сильных кислот - сульфат-ионы, реже хлорид-ионы, обусловливающие некарбонатную жёсткость.
При длительном кипячении воды, обладающей карбонатной жёсткостью, в ней появляется осадок, состоящий главным образом из карбоната кальция. Поэтому карбонатную жёсткость называют также временной жёсткостью. Количественно временную жёсткость характеризуют содержанием гидрокарбонатов, удаляющихся из воды при ее кипячении в течение часа. Жёсткость, оставшаяся после такого кипячения, называется постоянной жёсткостью. Суммарное содержание в воде всех солей кальция и магния составляет общую жёсткость.
Жёсткость воды выражают суммой миллимоль-эквивалентов ионов кальция и магния, содержащихся в одном литре воды. Один миллимоль-эквивалент жёсткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Mg2+.
Жёсткость природных вод изменяется в широких пределах. Она различна в разных водоёмах, а в одной и той же реке изменяется в течение года (минимальна во время паводка). Жёсткость вод морей значительно выше, чем рек и озёр. Так, вода Чёрного моря имеет общую жёсткость 65,5 ммоль-экв/л. Среднее значение жёсткости воды мирового океана 130,5 ммоль-экв/л (в том числе на Са2+ приходится 22,5 ммоль-экв/л, на Мg2+ - 108 ммоль-экв/л).
По значению жёсткости воду условно делят на мягкую (до 4 ммоль-экв/л), среднюю (4-8 ммоль-экв/л), жёсткую (8-12 ммоль-экв/л) и очень жёсткую (более 12 ммоль-экв/л).
Жёсткость воды может быть рассчитана по формуле
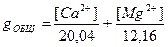 , (1)
, (1)
где [Ca2+] и [Mg2+] - концентрации ионов кальция и магния, мг/л,
или по формуле
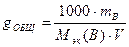 , (2)
, (2)
где mB – масса растворённого вещества, г; Мэк(В) – молярная масса эквивалентов вещества, г/моль; V – объём воды, л.
Вода обеспечивает от 10 до 30 % суточной потребности в кальции и магнии, являясь одним из важных источников этих ионов для человека. Известно, что суточная потребность указанных элементов для взрослого населения составляет 800 и 500—600 мг соответственно. В России особенно остро стоит проблема дефицита кальция в связи с низким потреблением молочных продуктов населением и невысоким содержанием этого элемента в почве преимущественно северных регионов. Последствия дефицита кальция и магния хорошо известны: нарушение работы желудочно-кишечного тракта, моче- и желчнокаменные болезни, остеопороз, нарушение ритма сердца. Особенно остро вопрос дефицита кальция стоит в пожилом возрасте, когда недостаток поступления кальция с пищей и водой усугубляется его повышенным выведением из организма.
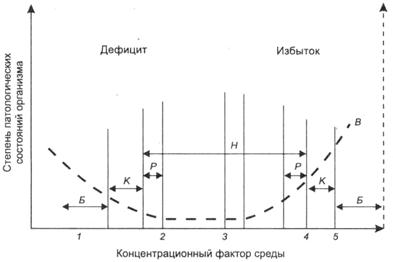 |
Согласно закону Либиха любой фактор окружающей среды, воздействуя на организм человека, проявляет оптимальное воздействие только в определенном интервале концентраций (рисунок 1). Для здоровья населения опасен как 1 – состояние недостатка химических элементов; 2 – нижняя пороговая концентрация; 3 – интервал нормальных концентраций (удовлетворительное состояние окружающей среды); 4 – верхняя пороговая концентрация; 5 – избыток химических элементов; Б, К, Р – интервалы концентраций химических элементов или их соотношение, соответствующее зонам экологического Бедствия, Кризиса и Риска
Рисунок 1 - Графическая интерпретация закона Либиха
дефицит, так и избыток того или иного компонента. Содержание в питьевой воде большого количества растворимых солей магния и кальция не только ухудшает её вкус, но и неблагоприятно при её бытовом использовании. В ней труднее развариваются продукты, и их питательная ценность уменьшается. Употребление жёсткой воды способствует развитию ряда заболеваний. Допускается жёсткость питьевой воды не выше 7 ммоль-экв/л и лишь в отдельных случаях по согласованию с санаторно-эпидемиологической службой допускается использование в водопроводных сетях воды с жёсткостью до 10 ммоль-экв/л.
 |
Так, в эпидемиологических исследованиях в Тамбовской области было установлено, что частота болезней органов пищеварения зависит от общей жёсткости питьевой воды, причем минимум заболеваемости приходится на показатель жёсткости 6-8 ммоль-экв/л (рисунок 2). В данном случае лимитирующим
Рисунок 2 - Частота болезней органов пищеварения населения Тамбовской области в зависимости от общей жёсткости питьевой воды
фактором окружающей среды является жёсткость питьевой воды, а зависимость частоты болезней от жёсткости воды (рисунок 2) повторяет кривую, описывающую закон Либиха.
Целью данной работы является оценка качества питьевой воды по показателю жёсткости.
Общую жёсткость воды определяют комплексонометрическим титрованием, карбонатную – титрованием соляной кислотой в присутствии метилового оранжевого, некарбонатную – по разности результатов этих определений.
Для определения общей жёсткости воды методом комплексонометрии используют трилон Б (двухзамещённая натриевая соль этилендиаминтетра-уксусной кислоты - ЭДТА) – наиболее сильный из известных в настоящее время комплексонов, который образует очень прочные комплексные соединения со многими металлами. При этом металл замещает атом водорода карбоксильных групп, одновременно связываясь с азотом аминогруппы.
В качестве индикаторов применяются различные красители, образующие окрашенные соединения с металлами, причем эти соединения менее устойчивы, чем комплексы определяемых металлов с трилоном Б, поэтому индикаторы вытесняются из комплекса с ионами металлов трилоном Б. На этом основано количественное определение металлов в растворах (в частности Ca2 + и Mg2 + ).
В данной лабораторной работе в качестве индикатора используют эриохром чёрный Т – представляющий собой азокраситель, обладающий сопряжённой системой двойных связей, обеспечивающей окраску данного соединения (синий цвет при рН более 8). В щелочной среде с ионами кальция и магния это соединение образует комплекс розово-фиолетового цвета. Без ионов кальция и магния цвет эриохрома чёрного Т в тех же условиях – синий.
|
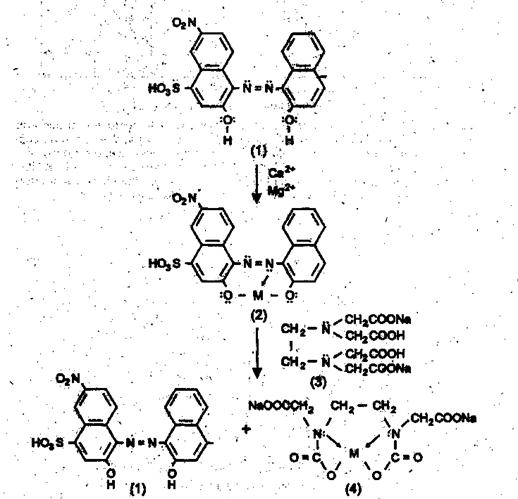
Схема химических превращений при определении общей жёсткости воды представлена на рисунке 3.
Рисунок 3 - Схема химических превращений при определении общей жёсткости воды
Количество ионов кальция и магния, находящихся в связанном состоянии (рисунок 3), определяют титрованием раствора комплекса (2) раствором ЭДТА (3) известной концентрации. В точке эквивалентности розовая окраска комплекса (2) исчезает, появляется синее окрашивание, соответствующее раствору свободного эриохрома чёрного Т (1). Комплекс (4) бесцветный.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 582; Нарушение авторских прав?; Мы поможем в написании вашей работы!