
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Максвелла для распределения молекул по скоростям
|
|
|
|
Давление газа пропорционально средней кинетической энергии поступательного движения молекулы.
Единица давления в СИ: 1 Па =1 Н/м2
Распределение большого числа молекул идеального газа, находящегося в состоянии термодинамического равновесия, по модулям скоростей подчиняется закону распределения Максвелла. Для получения дифференциального распределения Максвелла будем искать число частиц, скорости которых лежат в очень малом интервале d 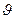 вблизи некоторой скорости
вблизи некоторой скорости 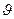 . Пусть dn – число частиц в единице объёма, скорости которых лежат в интервале от
. Пусть dn – число частиц в единице объёма, скорости которых лежат в интервале от 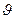 до d
до d 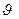 Это число пропорционально интервалу скоростей d
Это число пропорционально интервалу скоростей d 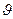 , а также пропорционально числу частиц в единице объёма. Можно записать так:
, а также пропорционально числу частиц в единице объёма. Можно записать так:
 , (7-10)
, (7-10)
где 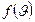 - плотность вероятности скорости, которая означает долю частиц в единице объёма, скорости которых лежат в единичном интервале скоростей вблизи скорости
- плотность вероятности скорости, которая означает долю частиц в единице объёма, скорости которых лежат в единичном интервале скоростей вблизи скорости 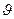 Тогда доля частиц, скорости которых лежат в интервале от
Тогда доля частиц, скорости которых лежат в интервале от 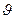 до
до 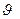 d
d 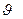 может быть найдена как
может быть найдена как
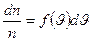 (7-11)
(7-11)
Поскольку число частиц, даже в малых объёмах вещества, очень велико, то 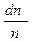 имеет смысл вероятности того, что любая частица идеального газа в единице объёма имеет скорость, лежащую в интервале скоростей от
имеет смысл вероятности того, что любая частица идеального газа в единице объёма имеет скорость, лежащую в интервале скоростей от 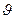 до
до 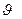 d
d 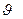 Распределение Максвелла в дифференциальной форме имеет вид:
Распределение Максвелла в дифференциальной форме имеет вид:
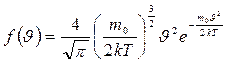 (7-12)
(7-12)
Вид дифференциального распределения Максвелла при разных значениях температуры представлен на рис.7.6. Площадь заштрихованной криволинейной трапеции численно равна доле частиц, скорости которых лежат в интервале от 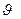 до
до 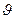 d
d 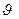 Скорость
Скорость  , соответствующая максимуму плотности вероятности
, соответствующая максимуму плотности вероятности 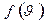 , называется наиболее вероятной скоростью. При
, называется наиболее вероятной скоростью. При 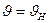 выполняется равенство
выполняется равенство  . Отсюда получаем, что наиболее вероятная скорость равна:
. Отсюда получаем, что наиболее вероятная скорость равна:
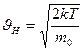 или
или 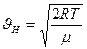 (7-13)
(7-13)
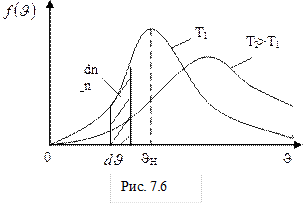
В отличие от распределения Гаусса, распределение Максвелла не симметрично относительно абсциссы максимума функции распределения. Это обусловлено наличием в формуле (7-12) квадрата модуля скорости, кроме экспоненты. При малых скоростях 
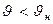 преобладает вклад
преобладает вклад 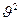 , поэтому при этих скоростях вид кривой дифференциального распределения (рис.7-6) близок к параболе, при
, поэтому при этих скоростях вид кривой дифференциального распределения (рис.7-6) близок к параболе, при  основной вклад вносит экспонента, которая убывает гораздо быстрее, чем растёт парабола. Площадь фигуры под кривой (
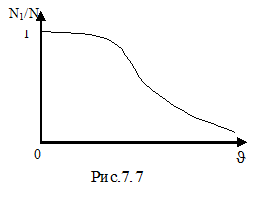
основной вклад вносит экспонента, которая убывает гораздо быстрее, чем растёт парабола. Площадь фигуры под кривой (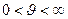 ) на рис.7.6 равна единице (условие нормировки) и выражает факт существования молекулы. При возрастании температуры увеличивается наиболее вероятная скорость, а плотность вероятности, соответствующая этой скорости, уменьшается, но площадь фигуры под кривой остаётся неизменной. Интегральное распределение Максвелла показано на рисунке 7.7. Здесь N1/N – доля частиц, скорости которых превышают скорость
) на рис.7.6 равна единице (условие нормировки) и выражает факт существования молекулы. При возрастании температуры увеличивается наиболее вероятная скорость, а плотность вероятности, соответствующая этой скорости, уменьшается, но площадь фигуры под кривой остаётся неизменной. Интегральное распределение Максвелла показано на рисунке 7.7. Здесь N1/N – доля частиц, скорости которых превышают скорость 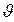 .
.
Таким образом, распределение Максвелла – это равновесное распределение идеального газа. Оно устанавливается благодаря столкновениям молекул, которые приводят систему к тепловому равновесию.
Распределение Максвелла позволяет определить несколько средних скоростей: наиболее вероятную скорость, среднюю арифметическую скорость и среднюю квадратичную скорость.
Скорость  , соответствующая максимуму плотности вероятности
, соответствующая максимуму плотности вероятности 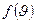 , называют наиболее вероятной скоростью. Для идеального газа, находящегося в состоянии термодинамического равновесия при температуре Т, она определяется из условия
, называют наиболее вероятной скоростью. Для идеального газа, находящегося в состоянии термодинамического равновесия при температуре Т, она определяется из условия  и равна
и равна 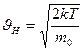 или
или 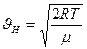 .
.
Средняя квадратичная скорость определяется как квадратный корень из среднего квадрата скорости 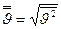 и связана со средней кинетической энергией поступательного движения молекул. Чтобы найти её с помощью распределения Максвелла, нужно определить отношение суммы квадратов скоростей молекул, содержащихся в единице объёма, к числу молекул в этом объёме:
и связана со средней кинетической энергией поступательного движения молекул. Чтобы найти её с помощью распределения Максвелла, нужно определить отношение суммы квадратов скоростей молекул, содержащихся в единице объёма, к числу молекул в этом объёме: 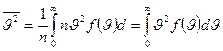 .
.
Для идеального газа, находящегося в состоянии термодинамического равновесия при температуре Т, она равна
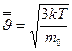 или
или 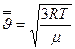 (7-14)
(7-14)
Среднюю арифметическую скорость  определяют как отношение суммы всех скоростей всех молекул в единице объёма к числу молекул в единице объёма:
определяют как отношение суммы всех скоростей всех молекул в единице объёма к числу молекул в единице объёма: 
 .
.
Для идеального газа, находящегося в состоянии термодинамического равновесия при температуре Т, она равна:
 .. (7-15)
.. (7-15)
Эти скорости мало отличаются друг от друга по своим численным значениям: 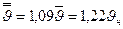 .
.
Экспериментально равновесное распределение частиц по скоростям было обнаружено Штерном, Истерманом и Симпсоном в 1947 году.
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 817; Нарушение авторских прав?; Мы поможем в написании вашей работы!