
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные законы идеальных газов
|
|
|
|
Термодинамика идеального газа
Теплота и работа как формы передачи энергии
ЛЕКЦИЯ 2
Теплота и работа представляют две формы передачи энергии от одного тела (или системы) к другому.
Процесс работы – макроскопический, который представляет собой упорядоченную форму передачи энергии в результате механического взаимодействия макротел. Обязательным условием механической работы является изменение объёма рабочего тела.
По своему существу понятие теплоты близко к понятию работы. Но процесс передачи энергии в форме теплоты от одного тела к другому представляет собой совокупность микроскопических процессов (передача энергии при соударении молекул). Таким образом, теплота – процесс микрофизический, осуществляющий обмен энергией между системой и окружающей средой, на молекулярном уровне. Теплота может передаваться либо непосредственным контактом между телами (теплопроводностью, конвенцией), либо на расстоянии (излучением), причём во всех случаях этот процесс возможен только при наличии разности температур между телами.
Но теплота и работа являются неравноценными формами передачи энергии: в то время как работа может быть непосредственно направлена на пополнение запаса любого вида энергии (магнитной, электрической, потенциальной и т.д.), теплота направлена на пополнение только внутренней энергии.
Под идеальным газом понимают совокупность материальных вполне упругих молекул, обладающих пренебрежимо малыми объёмами, находящихся в состоянии хаотического движения и лишённых сил взаимодействия (т.е. сил взаимного притяжения и отталкивания).
Отличие реального газа от идеального заключается в том что, в реальном газе в той или иной мере проявляются силы молекулярного взаимодействия, и в том, что фактически молекулы его занимают, хотя и очень малые, но тем не менее, вполне конкретные конечные по величине объёмы. Чем дальше отстоят молекулы газа друг от друга и чем меньше их линейные размеры по сравнению с расстояниями, отделяющими друг от друга, тем меньше становятся силы взаимодействия между ними и тем самым меньше реальный газ будет отличаться от идеального.
Закон Бойля - Мариотта. (изотермический процесс)
В 1662 г. Р. Бойль, а в 1676 г. Э. Мариотт независимо друг от друга установили зависимость опытным путем объёма газа от его давления при постоянной температуре.
При Т=const удельные объёмы данного газа обратно пропорциональны его абсолютным давлениям. 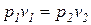 ,
, 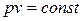 , (2.1)
, (2.1)
откуда 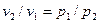
Закон Гей-Люссака (изобарный процесс)
В 1802г. Ж. Гей-Люссак, изучавший поведение газов при постоянном давлении, установил зависимость изменения объёма газа от его температуры.
При p = соnst Удельные объёмы газа прямо пропорциональны его абсолютным температурам 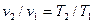 ;
; 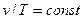 , (2.2)
, (2.2)
Закон Шарля (изохорный процесс)
В 1787 г. Ж. Шарль, исследовавший расширение газов, установил закон изменения
давления газа от изменения температуры при постоянном объёме.
При v=const данной массы газа абсолютные давления идеального газа прямо пропорциональные его абсолютным температурам. 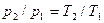 ;
; 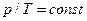 , (2.3)
, (2.3)
Закон Авогадро
В 1811 г. А. Авогадро открыл важный для физики и химии закон, в соответствии с которым в равных объёмах разных идеальных газов при одинаковых температуре и давлении содержится равное число молекул.
Допустим, что в двух одинаковых объёмах V1 =V2 двух различных идеальных газов – заполненном газом 1, находится N1 молекул этого газа при числе молекул в единице объёма, равном n1, а во втором объёме имеем: N2 и n2. Массы молекул и абсолютные давления газов равны соответственно m1 и m2 и p1 и p2.
Если давления газов одинаковы, то есть p1 = p2, то из уравнения (1.2) имеем
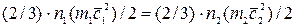 , (2.4)
, (2.4)
При одинаковых температурах (Т1=Т2) кинетическая энергия поступательного движения молекул одинакова, т.е. 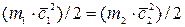 , (2.5)
, (2.5)
С учетом равенства (2.5) из уравнения (2.4) имеем n1 = n2, (2.6)
Умножая обе части равенства (2.6) на объём V1 = V2 = V, получаем
n1 V=n2 V, (2.7) или N1 =N2 =N, (2.8)
Из закона Авогадро вытекает важное следствие. Массы газов в первом и втором объёмах можно определить из выражений М1 = N1 m1, М2 = N2 m2, (2.9)
Отношение масс молекул газов m1/m2 равно отношению молекулярных масс этих газов 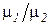 .Следовательно, можно записать
.Следовательно, можно записать 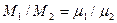 , (2.10)
, (2.10)
Из этого выражения следует, что отношение массовых количеств различных идеальных газов, заключенных в равных объемах и находящихся при p=const и T=const, равно отношению молекулярных масс этих газов. Перепишем выражение (2.10) в виде
(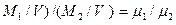 , или
, или 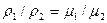 , (2.11)
, (2.11)
Отсюда видно, что отношение плотностей различных идеальных газов, заключенных в равных объёмах при равных давлениях и температурах, равно отношению молекулярных масс этих газов. Заменим отношение плотностей газов в уравнении (2.11) обратным отношением удельных объёмов. Тогда получим:
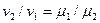 , или
, или 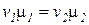 , (2.12)
, (2.12)
Следовательно, при одинаковых физических условиях произведение удельного объема
газа на его молекулярную массу есть величина постоянная и не зависит от природы газа:
v 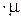 = idem
= idem
Произведение 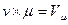 представляет собой объём 1 кмоля газа, (молярный объём).
представляет собой объём 1 кмоля газа, (молярный объём).
В Международной системе СИ за единицу количества вещества принимается – моль, под которым понимают количество вещества в граммах численно равное его молекулярной массе.
Установлено, что в 1 моле любого идеального газа содержится 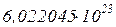 молекул. Это наз. числом Авогадро.
молекул. Это наз. числом Авогадро.
Поскольку объём 1 кмоля идеального газа при данных p и Т не зависит от природы газа, то его можно вычислить по любому газу. Так при НФУ p= 101,325 кПа=760 мм.рт.ст. и Т=273,15 К, объём 1 кмоля азота для которого 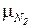 =28 кг/кмоль. Так как плотность азота при НФУ
=28 кг/кмоль. Так как плотность азота при НФУ 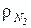 =1,25 кг/м3, то имеем:
=1,25 кг/м3, то имеем: 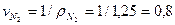 м3/кг
м3/кг
Следовательно: 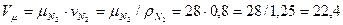 м3/кмоль
м3/кмоль
Из последнего выражения легко определяются 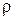 и v любого газа при НФУ
и v любого газа при НФУ
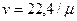 ;
; 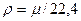 , (2.13)
, (2.13)
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1062; Нарушение авторских прав?; Мы поможем в написании вашей работы!