
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон: массы веществ, выделившихся на электродах прямопропорциональны количеству электричества (Q), прошедшего через раствор или расплав электролита
|
|
|
|
m =k . Q; Q=I·t;
Q-количество электричества, А . с;
I-сила тока, А;
t-время,с,ч;
k - электрохимический эквивалент, г/Кл.
Масса вещества, выделившегося при прохождении через электролит одного кулона электричества, называется электрохимическим эквивалентом
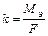 ;
; 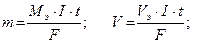 где
где
m – масса вещества, г;
V – объем вещества, л;
Мэ – молярная масса эквивалента, г/моль;
Vэ - эквивалентный объем, л/моль;
F – число Фарадея 96500 Кл/моль, 26,8 А·ч/моль.
II закон: при прохождении через различные электролиты одинакового количества электричества на электродах выделяются массы веществ, пропорционально молярным массам их эквивалентов (химические эквиваленты пропорциональны электрохимическим).
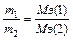

Вследствие протекания побочных процессов на электродах, образуется реально меньшее количество вещества, чем теоретически рассчитанное по вышеуказанной формуле. Для характеристики истинного количества вещества, выделяющегося на электродах, введено понятие выход по току (h).
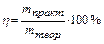 .
.
Задача. Составить схему электролиза раствора сульфата натрия. Написать уравнения катодного и анодного процессов, рассчитать количество образовавшихся при электролизе веществ (для газообразных – объем), если выход по току 70%, а через раствор пропускали ток силой 2А в течение 10 минут.
Сульфат натрия в растворе диссоциирует
Na2SO4 ↔ 2Na+ + SO42-
H2O
На катоде идет восстановление тех частиц, потенциал которых больше, 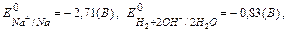
поэтому на катоде будет восстанавливаться вода по схеме:
К-: 2НОН + 2ē → Н2↑ + 2ОН -
к аноду направляются ионы SO42- и H2O.
На аноде окисляются те частицы, електрдный потенциал которых имеет меньшее значение,
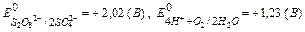 , поэтому будет идти окисление воды по схеме:
, поэтому будет идти окисление воды по схеме:
А +: 2Н2О - 4ē → О2 + 4Н+.
Суммарное уравнение электролиза Na2SO4
2Na2SO4 + 6H2O  2H2 + 4NaOH + O2 + 2H2SO4
2H2 + 4NaOH + O2 + 2H2SO4
на катоде у катода на аноде у анода
По закону Фарадея рассчитаем объемы V(Н2), V(О2) и массы m (NaOH), m (H2SO4), зная, что выход по току  (ή) составляет 70%.
(ή) составляет 70%.


 определяем по второму закону Фарадея:
определяем по второму закону Фарадея:
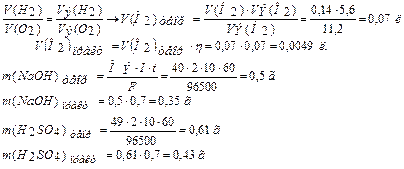
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 455; Нарушение авторских прав?; Мы поможем в написании вашей работы!