
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электродвижущая сила гальванического элемента
|
|
|
|
Электроды и электродные процессы в гальваническом элементе
Задача 2.3: Гальванический элемент состоит из двух стандартных металлических электродов (см. табл. 4). Укажите анод и катод и знаки их зарядов; запишите уравнения электродных процессов и схему гальванического элемента. Составьте уравнение токообразующей реакции в ионной и молекулярной форме.
Таблица 4 – Варианты заданий
| Электроды гальванического элемента | ||
| a | Cr/CrCl3 | Zn/ZnCl2 |
| b | Ni/NiSO4 | Cu/CuSO4 |
| c | Cu/CuSO4 | Ag/AgNO3 |
| d | Cr/CrCl3 | Cu/Cu(NO3)2 |
| e | Al/Al2(SO4)3 | Mg/MgCl2 |
| f | Cu/CuSO4 | Sn/SnCl2 |
| g | Mg/MgSO4 | Sn/SnSO4 |
| h | Pb/Pb(NO3)2 | Fe/FeSO4 |
| i | Sn/SnCl2 | Ni/NiSO4 |
| j | Ni/NiSO4 | Sn/SnCl2 |
| k | Au/Au(NO3)3 | Cu/CuCl2 |
| l | Zn/ZnSO4 | Ag/AgNO3 |
| m | (Pt)H2/H2SO4 | Zn/ZnSO4 |
| n | Mg/MgSO4 | Zn/Zn(NO3)2 |
| o | Ni/NiSO4 | Sn/SnCl2 |
| p | Cr/Cr2(SO4)3 | Ag/AgNO3 |
Для решения данной задачи воспользуйтесь рядом СЭП.
Помните, что анод – это электрод с меньшим потенциалом, а катод – с большим.
Пример решения задачи:
Гальванический элемент состоит из двух стандартных электродов – алюминиевого Al/AlCl3 и цинкового Zn/ZnCl2.
Учитывая значение СЭП: алюминиевый электрод (φ0 = -1.66 В), имеющий меньшее значение φ0, является восстановителем, на нем происходит процесс окисления, то есть анодный процесс
Al0 – 3e = Al3+, электрод Al/Al3+ - анод
Цинковый электрод с большим значением СЭП (φ0 = -0.76 В) является окислителем, на нем протекает процесс восстановления, т.е. катодный процесс
Zn2+ +2e = Zn0, электрод Zn/Zn2+ - катод
Всегда соблюдается соотношение φкатода > φанода.
При работе гальванического элемента электроны по внешней цепи передаются от анода к катоду, следовательно, анод заряжается отрицательно, а катод – положительно.
Схему гальванического элемента принято записывать в строку, слева – анод, справа – катод с указанием знака заряда
A(-): Al/AlCl3 || ZnCl2/Zn :(+)K
Двойная черта означает внутреннюю цепь (контакт между электролитами), она представляет проницаемую для анионов диафрагму или электролитический мост, по которому диффундируют анионы из катодного пространства в анодное.
Уравнение токообразующей реакции составляется с учетом электронного баланса.
Ионное уравнение: 2Al + 3Zn2+ = 2 Al3+ + 3Zn
Молекулярное уравнение: 2Al + 3ZnCl2 = 2AlCl3 + 3Zn
Задача 2.4: Рассчитайте величину электродвижущей силы для двух указанных гальванических элементов (см. табл. 5), сравните ее значения. На основании уравнений электродных процессов запишите схемы гальванических элементов и составьте уравнения токообразующих реакций. Концентрация электролитов 0.01 моль/л.
При решении задачи используйте ряд СЭП и уравнение Нернста.
Примеры решения задачи:
Пример 1: Рассчитать электродвижущую силу (ЭДС) гальванического элемента, составленного из серебряного Ag/Ag+ и железного Fe/Fe2+ электродов при [Ag+] = 0.01 моль/л и [Fe2+] = 0.1 моль/л.
ЭДС гальванического элемента (Е) численно равна разности электродных потенциалов при разомкнутой цепи: Е = Δφ = φкатода – φанода.
По формуле Нернста рассчитаем значения электродных потенциалов
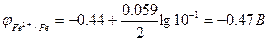
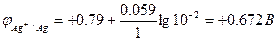
Электрод Fe/Fe2+ является анодом, Ag/Ag+ - катодом.
Е = 0.672 – (-0.47) = 1.152 В
Электродные процессы:
Анод (-): Fe – 2e = Fe2+ (окисление – анодный процесс)
Катод (+): Ag+ + 1e = Ag (восстановление – катодный процесс)
Уравнение токообразующей реакции:
Fe + 2Ag+ = Fe2+ + 2Ag
Fe + 2AgNO3 = Fe(NO3)2 + 2Ag
Схема гальванического элемента:
A(-): Fe/FeSO4 || AgNO3/Ag :(+)K
Таблица 5 – Варианты заданий
| Гальванические элементы | ||
| a | Ni/NiCl2 и Al/AlCl3 | Co/CoCl2 и Al/AlCl3 |
| b | Cr/CrCl3 и Ni/NiSO4 | Cr/CrCl3 и Co/CoCl2 |
| c | Zn/ZnSO4 и Ag/AgNO3 | Fe/FeSO4 и Ag/AgNO3 |
| d | Fe/FeSO4 и Zn/ZnSO4 | Fe/FeSO4 и Ni/NiSO4 |
| e | Cu/Cu(NO3)2 и Pb/Pb(NO3)2 | Cr/CrCl3 и Cu/Cu(NO3)2 |
| f | Ni/NiSO4 и Sn/SnCl2 | Ni/NiSO4 и Cu/Cu(NO3)2 |
| g | Mg/MgSO4 и Sn/SnSO4 | Al/Al2(SO4)3 и Mg/MgCl2 |
| h | Cr/CrCl3 и Fe/FeSO4 | Al/AlCl3 и Mg/MgSO4 |
| i | Hg/HgCl2 и Cu/CuSO4 | Mn/MnSO4 и Hg/Hg(NO3)2 |
| j | Cu/CuSO4 и Sn/SnCl2 | Mg/MgSO4 и Sn/SnSO4 |
| k | Ag/AgNO3 и Cu/CuSO4 | Sn/SnCl2 и Ni/NiSO4 |
| l | Ni/NiSO4 и Sn/SnCl2 | Au/Au(NO3)3 и Cu/Cu(NO3)2 |
| m | Zn/ZnSO4 и Ag/AgNO3 | Ni/NiSO4 и Zn/ZnSO4 |
| n | Ni/NiSO4 и Sn/SnSO4 | (Pt)H2/H2SO4 и Zn/ZnSO4 |
| o | Pb/Pb(NO3)2 и Fe/FeSO4 | Cr/CrCl3 и Cu/Cu(NO3)2 |
| p | Al/AlCl3 и Zn/ZnCl2 | Fe/FeSO4 и Ag/AgNO3 |
Пример 2: Рассчитать ЭДС концентрационного гальванического элемента, составленного из стандартного никелевого электрода и никелевого электрода при концентрации ионов Ni2+, равной 1∙10-4 моль/л.
Е = Δφ = φкатода – φанода.
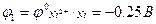
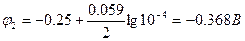
В концентрационном гальваническом элементе разность потенциалов обусловлена разной концентрацией электролита. Стандартный никелевый электрод является катодом, а никелевый электрод с меньшей концентрацией ионов Ni2+ является анодом (φ1>φ2).
Е = -0.25 – (-0.368) = 0.118 В
Схема гальванического элемента:
A (-): Ni/NiSO4 (1∙10-4 моль/л) || NiSO4 (1 моль/л)/Ni :(+) K
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 4549; Нарушение авторских прав?; Мы поможем в написании вашей работы!