
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коагуляция
|
|
|
|
Для дисперсных систем характерна кинетическая и агрегативная устойчивость. Под кинетической, или седиментационной, устойчивостью понимают способность частиц дисперсной фазы в результате диффузии и броуновского движения находиться во взвешенном состоянии. С уменьшением размера частиц такая устойчивость возрастает, поэтому коллоидно-дисперсные системы являются кинетически устойчивыми. Под агрегативной устойчивостью понимают способность частиц дисперсной фазы противодействовать их укрупнению путем слипания.
Устойчивость золя можно нарушить, устранив одноименный заряд коллоидных частиц и защитную гидратную оболочку. При введении в систему сильного электролита, имеющего противоионы по отношению к заряженным коллоидным частицам, число противоионов в коллоидной частице становится таким, что их заряд полностью нейтрализует заряд потенциалообразующих ионов, т.е. коллоидная частица становится незаряженной. Такое состояние частицы называется изоэлектрическим. Коллоидные частицы не защищены и при столкновении слипаются, укрупняются. Процесс укрупнения частиц, потеря агрегативной устойчивости золя называется коагуляцией. В результате коагуляции снижается кинетическая устойчивость системы, приводящая к седиментации хлопьев коагулята и разделению фаз. Таким образом, кинетическая неустойчивость приводит к агрегативной неустойчивости коллоидной системы.
Для начала явной, т.е. различимой глазом, коагуляции необходимо прибавить к золю некоторое минимальное количество электролита (С), называемое порогом коагуляции. При концентрациях электролита, меньших порога, коагуляция протекает в скрытом состоянии. Коагуляцию золей вызывают те из ионов прибавляемого электролита, заряд которых противоположен по знаку заряда коллоидных частиц. Коагулирующей способностью (Р) иона называется величина, обратная порогу коагуляции:
Р =  (132)
(132)
Коагулирующее действие иона в значительной степени зависит от его заряда. Чем выше заряд противоиона во введенном электролите, тем при меньшей концентрации наблюдается эффект коагуляции (правило Шульце – Гарди). Коагулирующая способность ионов одного и того же заряда зависит от гидратации ионов. Чем больше гидратация, тем больше порог коагуляции и ниже коагулирующая способность иона. Порог коагуляции золей невелик и выражается в моль/дм3 или мг-экв/ дм3.
Пример 32. В три колбы было налито по 100 см3 золя Fe(OH)3. Чтобы вызвать коагуляцию золя, потребовалось добавить в первую колбу 10,5 см3 1 н. хлорида калия, во вторую – 62,5 см3 0,01 н. сульфата натрия и в третью – 37,0 см3 0,001 н. фосфата натрия. Вычислите порог коагуляции каждого электролита и определите знак заряда частиц золя.
Решение. Определяем, сколько мг-экв KCl содержится в 10,5 см3 1 н. хлорида калия:
10,5 см3 ∙ 1 мг-экв/см3 =10,5 мг-экв KCl.
Общий объём раствора (золь + раствор электролита) равен:
100 см3 + 10,5 см3 = 110,5 см3.
Вычисляем порог коагуляции (мг-экв) для хлорида калия:
СKCl =  .
.
Аналогично рассчитываем пороги коагуляции для электролитов Na2SO4 и Na3PO4. В 62,5 см3 0,01 н. раствора Na2SO4 содержится:
62,5 см3 ∙ 0,01 мг-экв/см3 =0,625 мг-экв.
Порог коагуляции равен:
С Na2SO4 = 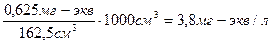
В 37,0 см3 0,001 н. раствора Na3PO4 содержится:
37,0 см3 ∙ 0,001 мг-экв/см3 =0,037 мг-экв Na3PO4.
Порог коагуляции равен:
С Na3PO4 = 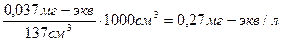 .
.
Электролиты KCl, Na2SO4 и Na3PO4 содержат катионы одинакового заряда, а анионы – разного заряда. Чем больше заряд иона, тем меньше оказывается порог коагуляции. Самый минимальный порог коагуляции и наивысшая коагулирующая способность и ионов 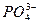 . Следовательно, частицы золя Fe(OH)3 заряжены положительно.
. Следовательно, частицы золя Fe(OH)3 заряжены положительно.
Пример 33. Пороги коагуляции золя Fe(OH)3 для электролитов KI и K2Cr2O7 соответственно равны 10,0 и 0,195 ммоль/л эоля.
Во сколько раз коагулирующая способность бихромата калия больше, чем у йодида калия?
Решение. Коагулирующие способности электролитов являются величинами, обратными их порогам коагуляции (132):
Р KI =  = 0,1; Р
= 0,1; Р  =
= 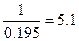 .
.
Р KI : Р  = 0,1: 5,1 = 1: 51.
= 0,1: 5,1 = 1: 51.
Для золя Fe(OH)3 коагулирующая способность бихромата калия больше, чем йодида калия, в 51 раз.
Вариант 1.
20. Пороги коагуляции электролитов для золя иодида серебра (моль/л): CKCl=256,0; CBa(NO3)2=6,0; CAl(NO3)3=0,067; CKNO3=260,0; CSr(NO3)2 =7,0. Определить знак заряда частиц данного золя и вычислить коагулирующую способность каждого из электролитов.
Вариант 2.
20. Золь иодида серебра получен смешиванием равных объёмов растворов иодида калия и нитрата серебра. Пороги коагуляции С(моль/л) для различных электролитов и данного золя имеют следующие значения: ССа(NO3)2 =315; CNaCl=300; CMgCl2=320; CNa3PO4=0,6; CNa2SO4=20; CAlCl3=330. Какой из электролитов: KI или AgNO3 взят в большей концентрации для приготовления золя? Дайте обоснованный ответ.
Вариант 3.
20. В три колбы налито по 50 см3 золя гидроксида железа. Чтобы вызвать коагуляцию золя, потребовалось добавить в первую колбу 5,30 см3 1н KCl; в другую – 31,5 см3 0,01н Na2SO4; в третью – 18,7 см3 0,001н Na3PO4. Вычислить порог коагуляции каждого электролита и определить знак заряда золя.
Вариант 4.
20. К 5см3 золя Fe(OH)3 для начала явной коагуляции необходимо добавить один из следующих растворов: 4см3 3н хлорида калия; 0,5см3 0,01н сульфата калия; 3,9см3 0,0005н железистосинеродистого калия. Вычислить порог коагуляции для этих электролитов. Во сколько раз коагулирующая способность K4[Fe(CN)6] выше, чем у K2SO4 и KCl?
Вариант 5.
20. Концентрации коагуляции электролитов (моль/л) для данного золя оказались равными:
С 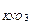 = 50,0; С
= 50,0; С 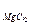 = 0,717; С
= 0,717; С  = 0,093; СNaCl = 51,0; С
= 0,093; СNaCl = 51,0; С  = 0,810;
= 0,810;
С 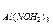 = 0,095.
= 0,095.
Определите знак заряда золя.
Вариант 6.
20. Пороги коагуляции электролитов для золя йодида серебра:
СKCl = 256,0; C 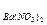 =6,0; С
=6,0; С  =0,067; С
=0,067; С 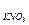 =260,0; С
=260,0; С 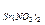 = 7,0.
= 7,0.
Определите знак заряда частиц данного золя и вычислите коагулирующую способность каждого из электролитов.
Вариант 7.
20. Золь хлорида серебра получен смешиванием равных объемов 0,0095 М хлорида калия и 0,012 н. нитрата серебра. Какой из электролитов: K3[Fe(CN)6], K4[Fe(CN)6] или MgSO4 будет иметь наибольший порог крагуляции для данного золя?
Вариант 8.
20. К 100 см3 0,003%-ного раствора хлорида натрия добавлено 250 см3 0,001 н. нитрата серебра. Для изучения коагуляции к полученному золю хлорида серебра добавлены следующие электролиты: KBr, Ba(NO3)2, K2CrO4, MgSO4, AlCl3. Какой из добавленных электролитов имеет наименьший порог коагуляции; наименьшую коагулирующую спосоность?
Вариант 9.
20. Для положительного золя Fe(OH)3 коагулирующими ионами являются анионы. Пороги коагуляции солей с одновалентными анионами близки между собой и составляют в среднем 10,69 ммоль/дм3. Соли с двухвалентными анионами имеют также близкие между собой пороги коагуляции 0,200 ммоль/дм3. Во сколько раз коагулирующая способность двухвалентных анионов больше, чем одновалентных?
Вариант 10.
20. Какое количество электролита 0,01 М K2Cr2O7 (см3) нужно добавить к 1л золя гидроксида алюминия, чтобы вызвать его коагуляцию? Порог коагуляции 0,63 ммоль/дм3.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 4714; Нарушение авторских прав?; Мы поможем в написании вашей работы!