
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Предельные подвижности ионов
|
|
|
|
Криоскопические константы некоторых растворителей
| Растворитель | 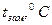
| К | Растворитель | 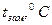
| К |
| Анилин | -6,0 | 5,87 | Нитробензол | 5,7 | 6,9 |
| Бензол | 5,5 | 5,1 | Пиридин | -42,0 | 4,97 |
| Вода | 0,0 | 1,86 | Серная кислота | 10,5 | 6,17 |
| 1,4-Диоксан | 12,0 | 4,7 | п -Тодуидин | 43,0 | 5,2 |
| Камфора | 178,4 | 39,7 | Уксусная кислота | 16,65 | 3,9 |
| п- Ксилол | 13,2 | 4,3 | Фенол | 41,0 | 7,3 |
| Муравьиная кислота | 8,4 | 2,77 | Четырёххлористый углерод | -23,0 | 2,98 |
| Нафталин | 80,1 | 6,9 | Циклогексан | 6,5 | 20,2 |
Таблица 4
Константы диссоциации слабых кислот и оснований при 25ºС
| Кислота | Ка |
| Фтористоводородная HF | 6,7∙10-4 |
| Хлорноватистая HClO | 1,0∙10-8 |
| Бромноватистая HBrO | 2,0∙10-9 |
| Сероводородная H2S | 1,1∙10-7 1,0∙10-14 |
| Сернистая H2SO3 | 1,7∙10-2 1,0∙10-7 |
| Азотистая HNO2 | 5,0∙10-4 |
| Фосфорная H3PO4 | 1,1∙10-2 2,0∙10-7 3,6∙10-13 |
| Циановодородная HCN | 4,0∙10-10 |
| Угольная H2CO3 | 4,4∙10-7 5,6∙10-11 |
| Уксусная CH3COOH | 1,8∙10-5 |
| Муравьиная HCOOH | 1,77∙10-4 |
| Бензойная C6H5COOH | 6,3∙10-5 |
| Фенол C6H5OH | 1,0∙10-10 |
| Основания | Kb |
| Анилин C6H5NH2 | 3,8∙10-10 |
| Гидроксид аммония NH4OH | 1,8∙10-5 |
| Гидразин N2H4∙H2O | 1,7∙10-6 |
| Пиридин C6H5N | 1,7∙10-9 |
| Метиламин CH3NH2 | 6,7∙10-4 |
| Этиламин C2H5NH2 | 4,38∙10-4 |
| Диметиламин (CH3)2NH | 5,2∙10-4 |
| Триметиламин (CH3)3N | 5,4∙10-5 |
Таблица 5
(См∙см∙моль-1) при 25ºС
| Катион | 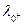
| Анион | 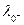
|
| Н+ | 349,8 | OH- | 198,0 |
| К+ | 73,5 | I- | 76,8 |
| Na+ | 50,1 | Br- | 78,4 |
| Li+ | 38,7 | Cl- | 76,3 |
| Ag+ | 61,9 | NO 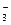
| 71,4 |
| Ba2+ | 127,2 | CH3COO- | 40,9 |
| Ca2+ | 119,0 | SO 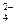
| 160,0 |
| Mg2+ | 106,1 | [Fe(CN)6]3- | 297,0 |
| Al3+ | 189,0 | [Fe(CN)6]4- | 444,0 |
| Fe3+ | 204,0 |
Таблица 6
Стандартные электродные потенциалы при Т=298 К
| Электрод | Электродная реакция | Е0, В |
| Li+/Li | Li+ + e ↔ Li | -3,045 |
| Rb+/Rb | Rb+ + e ↔ Rb | -2,925 |
| K+/K | K+ + e ↔ K | -2,925 |
| Cs+/Cs | Cs+ + e ↔ Cs | -2,923 |
| Ba2+/Ba | Ba2+ + 2e ↔ Ba | -2,906 |
| Ca2+/Ca | Ca2+ + 2e ↔ Ca | -2,866 |
| Na+/Na | Na+ + e ↔ Na | -2,714 |
| La3+/La | La3+ + 3e ↔ La | -2,522 |
| Mg2+/Mg | Mg2+ + 2e ↔ Mg | -2,363 |
| Be2+/Be | Be2+ + 2e ↔ Be | -1,847 |
| Al3+/Al | Al3+ + 3e ↔ Al | -1,662 |
| Ti2+/Ti | Ti2+ + 2e ↔ Ti | -1,628 |
| V2+/V | V2+ + 2e ↔ V | -1,186 |
| Mn2+/Mn | Mn2+ + 2e ↔ Mn | -1,180 |
| Sm3+/Sm2+ | Sm3+ + e ↔ Sm2+ | -1,150 |
| Cr2+/Cr | Cr2+ + 2e ↔ Cr | -0,913 |
| Zn2+/Zn | Zn2+ + 2e ↔ Zn | -0,763 |
| Cr3+/Cr | Cr3+ + 3e ↔Cr | -0,744 |
| In3+/In2+ | In3+ + e ↔ In2+ | -0,450 |
| Fe2+/Fe | Fe2+ + 2e ↔ Fe | -0,440 |
| Cr3+/Cr2+ | Cr3+ + e ↔ Cr2+ | -0,408 |
| Cd2+/Cd | Cd2+ + 2e ↔ Cd | -0,403 |
| Ti3+/Ti2+ | Ti3+ + e ↔ Ti2+ | -0,368 |
| Co2+/Co | Co2+ + 2e ↔Co | -0,277 |
| V3+/V2+ | V3+ + e ↔ V2+ | -0,256 |
| Ni2+/Ni | Ni2+ + 2е ↔ Ni | -0,250 |
| Sn2+/Sn | Sn2+ + 2е ↔ Sn | -0,136 |
| Pb2+/Pb | Pb2+ + 2е ↔ Pb | -0,126 |
| Fe3+/Fe | Fe3+ + 3е ↔ Fe | -0,036 |
| H+/H2 | H+ + е ↔ ½ H2 | 0,000 |
| Sn4+/Sn2+ | Sn4+ + 2е ↔ Sn2+ | +0,150 |
| Cu2+/Cu+ | Cu2+ + е ↔ Cu+ | +0,153 |
SO 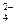 /H2S /H2S
| SO 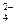 + 10Н+ + 8е ↔ H2S(водн) + 4Н2О + 10Н+ + 8е ↔ H2S(водн) + 4Н2О
| +0,303 |
| Cu2+/Cu | Cu2+ + 2е ↔ Cu | +0,337 |
| O2/OH- | ½ O2 + Н2О + 2е ↔ OH- | +0,401 |
| Cu+/Cu | Cu+ + е ↔ Cu | +0,521 |
| I2/I- | I2 + 2е ↔ I- | +0,536 |
| Fe3+/Fe2+ | Fe3+ + е ↔ Fe2+ | +0,771 |
| Ag+/Ag | Ag+ + е ↔ Ag | +0,799 |
| Hg2+/Hg | Hg2+ + 2е ↔ Hg | +0,854 |
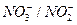
| 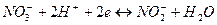
| +0,940 |
| Pd2+/Pd | Pd2+ + 2е ↔ Pd | +0,987 |
| Br2/Br- | ½ Br2 + е ↔ Br- | +1,065 |
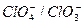
| 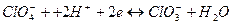
| +1,190 |
| Pt2+/Pt | Pt2+ + 2е ↔ Pt | +1,200 |
| Ti3+/Ti+ | Ti3+ + 2е ↔ Ti+ | +1,250 |
 Cr2O Cr2O 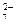 /Cr3+ /Cr3+
|  Cr2O Cr2O 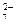 + 14Н+ + 6е ↔ Cr3+ + 7Н2О + 14Н+ + 6е ↔ Cr3+ + 7Н2О
| +1,330 |
| Cl2/Cl- | ½ Cl2 + е ↔ Cl- | +1,359 |
| PbO2/Pb2+ | PbO2 + 14Н+ + 2е ↔ Pb2+ + 2Н2О | +1,455 |
| Au3+/Au | Au3+ + 3е ↔ Au | +1,498 |
MnO 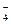 /Mn2+ /Mn2+
| MnO 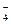 + 8Н+ + 5е ↔ Mn2+ + 4Н2О + 8Н+ + 5е ↔ Mn2+ + 4Н2О
| +1,510 |
| HClO2/HClO | HClO2 + 2Н+ + 2е ↔ HClO + 2Н2О | +1,640 |
| PbO2/PbSO4 | PbO2 + 4Н+ + SO 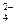 +2е ↔ PbSO4 + 2Н2О +2е ↔ PbSO4 + 2Н2О
| +1,685 |
| H2O2/H2O | H2O2 + 2Н+ + 2е ↔ 2H2O | +1,776 |
| Co3+/Co2+ | Co3+ + е ↔ Co2+ | +1,810 |
S2O 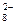 /SO /SO 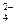
| S2O 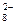 + 2е ↔ 2SO + 2е ↔ 2SO 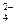
| +2,010 |
| H2/H- | ½ H2 + е ↔ H- | +2,200 |
| F2/F- | ½ F2 + е ↔ F- | +2,866 |
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1561; Нарушение авторских прав?; Мы поможем в написании вашей работы!