
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение, функции и свойства ДНК. 1 страница
|
|
|
|
Белки.
Макромолекулы как обьекты изучения молекулярной биологии
Белки, их роль в обеспечении биологической специфичности. Аминокислоты, их свойства. Формирование полипептидной цепи. Первичная, вторичная, третичная и четвертичная структуры белка. Конформация – основа свойств белка. Фолдинг. Понятие о прионных заболеваниях. Классификация белков согласно их биологическим функциям. Белки-переносчики, сигнальные, защитные, структурные, рецепторные, регуляторные, ферменты. Понятие о протеомике.
Макромолекулы клетки. Из простых органических молекул синтезируются более крупные макромолекулы. Макромолекула — это крупная молекула, построенная из многих повторяющихся единиц. Она представляет собой полимер, состоящий из мономеров. Существует 3 типа макромолекул: белки, нуклеиновые кислоты и полисахариды. Некоторые липиды условно можно считать макромолекулами. Макромолекулы составляют до 90 % сухой массы клеток.
Клетки в значительной степени состоят из белков, на долю которых приходится более половины от сухого вещества. Белки определяют структуру и форму клетки; кроме того, они служат инструментами молекулярного узнавания и катализа. Белки непосредственно участвуют в процессах обмена веществ, метаболизме и поддержании всех функций клетки.
Белки – это полимерные биоорганические соединения, мономерами которых являются остатки аминокислот, соединенных кислото – амидными (пептидными) связями (─NH─C(O)─).
Аминокислоты. Аминокислотами называются соединения, содержащие одновременно амино- и карбоксильную группу:
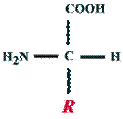
По числу аминных и карбоксильных групп, а также в зависимости от радикала R аминокислоты подразделяются на моноаминокарбоновые (глицин, аланин, валин, лейцин, изолейцин, серин, треонин, метионин, цистеин, цистин), диаминокарбоновые (лизин, аргинин), аминодикарбоновые (аспарагиновая и глутаминовая кислоты), ароматические (фенилаланин, тирозин) и гетероциклические (пролин, оксипролин, гистидин, триптофан).
Если принять во внимание полярность и заряд радикала R, то можно разделить аминокислоты на четыре класса:
–аминокислоты с неполярными (гидрофобными) R-группами (аланин, валин, лейцин, изолейцин, метионин, пролин, триптофан, фенилаланин);
–аминокислоты с полярными (гидрофильными) незаряженными R-группами (глицин, серин, треонин, цистеин, тирозин, аспарагин, глутамин);
–аминокислоты с отрицательно заряженными R-группами (кислые аминокислоты – аспарагиновая и глутаминовая кислоты);
–аминокислоты с положительно заряженными R-группами (основные аминокислоты – лизин, аргинин, гистидин).
Отмеченные 20 аминокислот входят в состав природных белков и пептидов и называются протеиногенными. Они имеют такие свойства: 1) кислотно – основные, т.е., являясь амфотерными электролитами, могут диссоциировать с образованием анионов или катионов; 2) полярность – могут быть гидрофильными или гидрофобными; 3) оптичность – ά-атом углерода представляет центр молекулы всех (кроме глицина) аминокислот и они поэтому являются оптически активными соединениями; 4) способность к образованию кислотно – амидных (пептидных) связей; 5) химические реакции (нингидриновая, флуорескаминовая, ксантопротеиновая, Милона, Сакагучи, Эрлиха, Фоля), которые используются в аналитической и клинической биохимии для идентификации и количественного определения отдельных аминокислот(в плазме крови, моче и др.).
По своей абсолютной конфигурации протеиногенные аминокислоты являются стереоизомерами L- ряда (L- аминокислотами).D- аминокислоты в состав природных белков не входят. Они есть в некоторых антибиотиках – грамицидине и актиномицине D.
Из 20 протеиногенных аминокислот 10 являются для человека незаменимыми, то есть не синтезируемыми в организме - аргинин, лизин, валин, гистидин, лейцин, изолейцин, треонин, триптофан, метионин, фенилаланин. Исключение какой-либо незаменимой аминокислоты из пищи приводит к развитию отрицательного азотистого баланса, истощению, остановке роста. Дефицит в пище отдельных незаменимых аминокислот вызывает нарушение синтеза белка с последующими клиническими симптомами. Например, дефицит триптофана вызывает развитие катаракты, выпадение волос, поражение зубов, снижение массы тела. Триптофан является предшественником в биосинтезе таких физиологически активных соединений, гормонального и медиаторного действия, как серотонин и никотиновая кислота. Дефицит лизина вызывает повышенную восприимчивость к шуму, тошноту, головокружение. Отсутствие лейцина у молодых людей сопровождается головными болями, потерей аппетита, быстрой утомляемостью, психической подавленностью. При нарушении метаболизма лейцина, изолейцина и валина развивается болезнь «кленового сиропа» (замедление роста, нарушение питания, сонливость, неврологические состояния). Важным участником внутриклеточного метаболизма и донором метильной (─CH3) группы в многочисленных реакциях метилирования является метионин. Аргинин принимает участие в образовании мочевины – конечного продукта аминобмена. Кроме того, установлена роль аргинина как предшественника в генерации оксида азота (NO) – модулятора таких физиологических функций: регуляции тонуса гладких мышц, иммунных процессов и нейротрансмиссии. Фенилаланин и тирозин обеспечивают образование главных катехоламинов организма (дофамина, норадреналина, адреналина), тиреоидных гормонов и меланинов. Нарушение обмена этих аминокислот приводит к ряду заболеваний: фенилкетонурии, алкаптонурии, альбинизму, тирозинемии. Аминокислота гистидин путем декарбоксилирования превращается в гистамин – важнейший медиатор аллергии, а также физиологический регулятор деятельности различных клеток и систем, включая иммунокомпетентную систему.
Аминокислоты, поступающие в организм с пищей, образующиеся при катаболизме белков и в результате синтеза, формируют аминокислотный пул организма — источник аминокислот для образования различных веществ (рис.1).
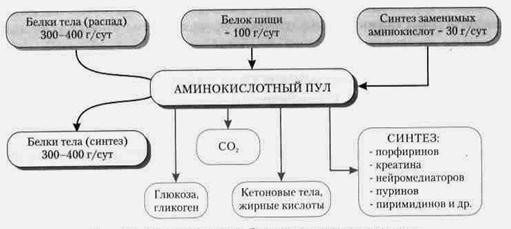
Рис.1. Пути превращения аминокислот
Обмен аминокислот в тканях можно условно разделить на общие и специфические пути превращения. К общим путям обмена аминокислот относятся:
дезаминирование;
трансаминирование;
декарбоксилирование.
Дезаминирование - процесс отщепления аминогруппы в виде аммиака с образованием а-кетокислоты.
Трансаминирование — процесс переноса аминогруппы аминокислоты на кетокислоту без промежуточного образования аммиака. Процесс трансаминирования имеет большое значение для синтеза заменимых аминокислот в организме животных и человека. Через а-кетоглутарат аммиак используется для синтеза заменимых аминокислот, этим же путем аминогруппа переносится на аминосахара, порфирины, креатин.
Нарушение процессов трансаминирования может быть следствием изменения соотношения продуктов реакции (избыток аминокислот в организме), нарушений в процессах окисления в цикле трикарбоновых кислот или синтеза трансаминаз.
Кроме приведенных 20 аминокислот (пролин – иминокислота), участвующих в построении молекул белков, в тканях живых организмов имеются и другие аминокислоты, важные промежуточные продукты обмена веществ (орнитин, цистатионин и др.).
Белки. Если от двух молекул аминокислот отнять одну молекулу воды, то образуются неполные ангидриды, которые называются дипептидами. Они имеют пептидную связь ─NH─C(O)─. Дипептид обладает способностью взаимодействовать с новой молекулой аминокислоты с образованием нового неполного ангидрида – трипептида. Таким же способом могут быть получены тетрапептиды, пентапептиды и т.д., носящие общее название полипептидов. Последние играют очень важную роль в построении молекул белков.
В макромолекулу белка входит одна или несколько пептидных цепей, связанных друг с другом поперечными химическими связями, чаще всего через серу (дисульфидные мостики, образуемые остатками цистеина). Химическую структуру пептидных цепей принято называть первичной структурой белка или секвенцией.
Для построения пространственной структуры белка пептидные цепи должны принять определенную, свойственную данному белку конфигурацию, которая закрепляется водородными связями, возникающими между пептидными группировками отдельных участков молекулярной цепи. По мере образования водородных связей пептидные цепи закручиваются в спирали (α-спираль), стремясь к образованию максимального числа водородных связей и соответственно к энергетически наиболее выгодной конфигурации.
В зависимости от образования определенной пространственной структуры (конформации) различают вторичную, третичную, четвертичную и доменную организацию белков (рис.2).
Вторичная структура белков – это ряд конформаций, образуемых водородными связями. Различают два основных типа упорядоченной вторичной структуры белковых молекул: правозакрученная α-спираль и β- структура. Последняя представляет собой слоистую молекулу, состоящую из зигзагообразных развернутых полипептидных цепей, расположенных рядом и соединенных водородными связями. Многие белки имеют оба типа вторичной структуры.
Третичная структура белков образуется путем укладки в трехмерном пространстве полипептидной цепи с определенной вторичной структурой. В образовании и стабилизации третичной структуры принимают участие водородные, ионные и гидрофобные связи. В зависимости от формы и особенностей трехмерной пространственной структуры, все белки делятся на два класса: глобулярные и фибриллярные. Глобулярные белки (ферменты, антитела, некоторые гормоны и др.) имеют округлую форму, а фибриллярные (коллаген, эластин, α-кератин и др.) – вытянутую.
Четвертичная структура белков (гемоглобин и др.) – результат объединения (агрегации) нескольких полипептидных цепей или протомеров, каждый из которых имеет свою типичную конформацию. Отдельные протомеры (субъединицы) в таких белках соединяются нековалентными связями, что приводит к их диссоциации и потере биологической активности при изменении условий среды.
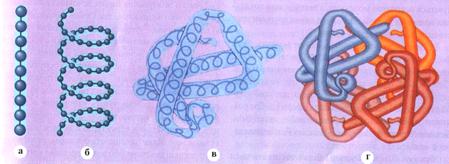
Рис.2. Уровни структурной организации белков: а) - первичная структура - линейная последовательность аминокислот (образование полипептидов); б) — вторичная структура - образование спирали из полипептидной цепи или β-структуры; в) - третичная структура - образование глобулы из полипептидной спирали и β-структуры; г) - четвертичная структура - образование белкового комплекса, состоящего из нескольких полипептидных глобул
Доменная организация белков (р-53, фосфоглицераткиназа и др.) представляет собой глобулярные участки (100 – 150 аминокислотных остатков), расположенные в середине молекулы с третичной структурой. Отдельные домены – это относительно функциональные автономные образования в составе белковых молекул, связанные между собой пептидными фрагментами («шарнирными» участками), которые можно расщепить только при помощи протеолитических ферментов.
Процесс сворачивания пептидной цепи в пространственную структуру и достижение белком правильной конфигурации называется фолдингом. Для небольших белков характерно самопроизвольное образование третичной структуры, а для фолдинга крупных белков необходимы специальные вспомогательные белки – шапероны и ферменты - фолдазы. Фолдинг с участием фолдаз и шаперонов обычно приводит полипептидную цепь к «правильной», наиболее оптимальной в энергетическом и функциональном отношениях, структуре.
Однако бывают случаи «неправильного» фолдинга. Существует группа тяжелых неврологических болезней, которые обусловлены закономерно повторяющимся «неправильным» фолдингом одного, вполне определенного белка. Данный белок, если он находится в нормальной конформации, называется прион - протеином. Он кодируется геном, расположенным у человека в 20-й хромосоме. Белок входит в состав наружных клеточных мембран и участвует в эндоцитозе и катаболизме клеток. Его могут синтезировать многие клетки организма, но самый высокий уровень концентрации этого белка выявлен в нейронах. Роль нормального прион-протеина у здоровых индивидуумов еще до конца не установлена, но известно, что он поддерживает «циркадианные» ритмы, то есть околосуточные ритмы активности и покоя в клетках, тканях органах и в организме в целом.
К настоящему времени установлено 18 различных мутаций человеческого гена прион – протеина, которые связаны с различными прионовыми болезнями. В результате мутаций этого гена образуется белок с другой конформацией. Он имеет участки с β-структурой, почти отсутствующие в нативной форме, и повышенную склонность к агрегации. В данной форме он, видимо, не способен выполнять свои обычные функции и вызывает заболевание – прионовые энцефалопатии. Прионовые болезни уникальны с генетической и инфекционной точки зрения, т.е. они являются одновременно и наследственными (аутосомно–доминантный тип наследования), и инфекционными (трансмиссия инфекционного агента алиментарным или ятрогенным путем). При попадании инфекционного прионного белка в здоровый организм, его молекулы соединяются с молекулами клеточного (нормального) прион-протеина, в котором происходят конформационные изменения: две из четырех спирально завитых структур вытягиваются, и молекула такого белка становится инфекционной, т.е. происходит как бы фолдинг наоборот. Более того, процесс является автокаталитическим: вновь образовавшиеся порции «испорченного» белка начинают «портить» очередные порции нативного белка до тех пор, пока весь белок не оказывается «испорчен».
Таким образом, в отличие от всех известных инфекционных агентов, инфекционный прионный белок не синтезируется заново, а накапливается исключительно за счет превращения нормального клеточного белка в инфекционный. Процесс происходит относительно медленно – болезнь развивается в течение нескольких лет, но неотвратимо приводит к гибели животного или человека.
У коров инфекционные прионы вызывают губчатую энцефалопатию или коровье бешенство. Употребление человеком мяса таких коров вызывает новый вариант болезни Крейцфельда-Якоба (инкубационный период более 10 лет). При развитии клинических проявлений (нарушения психики, чувствительной и двигательной сферы) нет ни признаков воспаления, ни биологических аномалий в крови, ни тестов неинвазивных, ни прямых, ни косвенных, позволяющих уверенно поставить диагноз. Это заболевание опасно тем, что оно может передаться от заболевшей матери ребенку, вызвав всплеск преждевременных смертей в следующем поколении людей.
Начиная с 1995 года, в течение 5 лет от этой болезни умерло 86 человек. К прионовым болезням относятся также куру, которая поражает туземцев Новой Гвинеи, и скрепи (почесуха) овец.
Таким образом, как видим, фолдинг – очень важный этап в формировании белков.
Функции белков. Белки являются наиболее распространенными из всех классов биомолекул; они входят в состав всех клеточных компонентов микроорганизмов, растений, животных (ядра, биомембран, цитоплазмы) и межклеточных структур. Белковый состав живых клеток усложняется пропорционально степени сложности генома и этапов эволюционного развития организма.
Белковые молекулы - важнейшие нутриенты. Взрослый человек должен получать ежесуточно 100-120 г белка (при энергозатратах 12 000 кДж). Потребность в белке возрастает при физической нагрузке, беременности, лактации. При беременности (2 и 1 триместры) дополнительно требуется 6 г белка в сутки, во время лактации прием белка должен увеличиваться на 15 г.
При сбалансированном питании не менее 5% энергетических затрат должно покрываться за счет белков (оптимальным уровнем считается 18%).
Одним из путей превращения компонентов аминокислотного пула организма является синтез белков плазмы крови, принимающих участие в поддержании рН крови, определении вязкости, коллоидно-осмотического давления, в транспорте гормонов, липидов, жирных кислот, пигментов, жирорастворимых витаминов, поддержании уровня катионов крови, в свертывании крови, иммунных и других процессах.
Плазма содержит свыше 300 белков, но только незначительное их число определяется в повседневной клинической практике. Большинство белков плазмы — гликопротеины, количество углеводов в их составе варьирует от 1% до 40%. Исследования белков плазмы, кроме специфической нозологической информации, дают определенное представление о состоянии белкового обмена в целом. Основная масса белков плазмы синтезируется в печени. Гепатоциты участвуют в синтезе 95% альбуминов, в синтезе фибриногена, a- и b-глобулинов. компонентов свертывающей системы. Большая часть b- и y-глобулинов синтезируется в клетках иммунной системы.
Одно из центральных мест в диагностике патологических состояний организма человека занимают исследования белкового спектра, активности ферментов крови и других биологических жидкостей.
В соответствии с биологическими функциями можно выделить белки – переносчики, сигнальные, защитные, структурные, рецепторные, регуляторные, ферменты и др.
Ферментативная (каталитическая) функция. Все ферменты (биокатализаторы) по своей химической природе являются белками или комплексами белков с низкомолекулярными небелковыми соединениями (коферментами, кофакторами).
Ферменты (Ф) — протеины, содержащие хиральные распознающие участки для специфических субстратов, и, в силу этого, являющиеся высокоэффективными биокатализаторами, ускоряющими химические реакции в 10ю—1016 раз. Слово «фермент» — производное от латинского fermentum, т. е. «закваска», а часто употребляемый синоним «энзим» произошел от греческого «эн зюме», что означает «в дрожжах».
Энзимы могут быть однокомпонентными (простые белки), двухкомпонентными и многокомпонентными; большинство из них - глобулярные белки.
В составе Ф есть активный центр — особый участок в молекуле белка, с которым связывается субстрат с образованием фермент - субстратного комплекса (Ф—С). В полипептидной последовательности аминокислотные остатки, составляющие активный центр, могут находиться далеко друг от друга, однако благодаря специфичной для каждой белковой молекулы упаковке, эти фрагменты пространственно сближены. Формирование комплекса Ф-С осуществляется, как правило, без ковалентного связывания, за счет водородных связей, ион-дипольного, диполь-дипольного или ван-дер-ваальсового взаимодействия.
Во многих случаях в непосредственной близости к активному центру Ф находится небелковый компонент. Последний получил название кофермента (коэнзима) или кофактора, а белковая часть—апо-фермента (ароЕ). В качестве коферментов могут выступать как органические молекулы (главным образом витамины или их производные), так и ионы Са2+, Zn2+, Mn2+, Se2+, Cu2f, Fe2+ и др. В ряде случаев кофакторы образуют с Ф прочные связи. При этом небелковую часть Ф принято называть простетической группой.
В настоящее время зарегистрировано около 106 Ф, у млекопитающих их примерно 2400. Ф классифицируются не как индивидуальные химические соединения, а по типу катализируемых ими реакций. Выделяют шесть классов Ф, каждый из которых подразделяется на подклассы и более мелкие группы.
Оксидоредуктазы - окислительно-восстановительные Ф. Их систематическое название складывается из названия восстановителя (электронодонора), окислителя (электроно-акцептора) и названия класса. Например, Ф, катализирующий окисление этанола до ацетальдегида при участии NAD+, носит название — алкоголь: NАD+-оксидоредуктаза или алкогольдегидрогеназа.
Известно более 200 биохимических реакций окисления спиртовых групп до карбонильных и несколько десятков превращений карбонильных групп в карбоксильные, протекающих при участии никотинамидных коферментов. Большинство из этих процессов обратимы. Однако, как правило, биологически значимым является только одно направление. Чрезвычайно важная роль в защите организма на молекулярном и клеточном уровнях от повреждающего действия сильного окислителя — радикала Н02- принадлежит супероксиддисмутазе. Этот Ф является металлопротеидом и может содержать в качестве кофактора ионы Zn2+, Mn2+, Cu2+, Fe2+.
Трансферазы. Катализируют перенос различных групп с одной молекулы на другую. Такого рода превращения играют чрезвычайно важную роль в синтезе пиримидиновых и пуриновых оснований. В качестве коферментов, переносящих одноуглеродные фрагменты, в этих реакциях выступают тетрагидрофолат и S-аденозилметионин. Последний является главным метилирующим агентом в клетках и участвует в десятках реакций, катализируемых метилтрансферазами. Энзимы, катализирующие перенос альдегидных и кетогрупп представлены транскетолазой и трансальдолазой, участвующие в синтезе моно- и полисахаридов.
Ацетилтрансферазы катализируют такие важные биохимические процессы как перенос ацильных остатков. Гликозилтрансферазы катализируют перенос гликозильных остатков. Эти Ф играют ведущую роль в синтезе и первом этапе деструкции полисахаридов.
Очень важной группой Ф являются аминотрансферазы. Они катализируют реакции образования и деградации аминокислот.
Гидролазы. Катализируют процессы гидролитического расщепления различных связей. Ф, гидролизующие внутренние пептидные связи в белках, называют протеазами, а катализирующие отщепление N-концевой аминокислоты — аминопептидазами, отщепление С-концевой аминокислоты — карбоксипептидазами, гидролиз нуклеиновых кислот — нуклеазами. Значительная часть гидролаз представлена пищеварительными ферментами (амилазы, липазы, фосфолипазы, пепсин и т. п.), с помощью которых поступающие с пищей полисахариды, жиры и протеины расщепляются соответственно до моносахаридов, глицерина и жирных кислот, пептидов и аминокислот. Последующая реутилизация образовавшихся мономеров в ходе анаболических процессов, протекающих согласно наследственным программам, приводит к построению новых биополимеров, присущих данному организму.
Кроме утилизирующей роли следует подчеркнуть и такую функцию протеаз, как процессинг белков и РНК. Процессингом называют образование «зрелых» молекул белков из их синтетических предшественников. Многие протеины, которые реализуют свою активность вне пределов синтезирующей их клетки (некоторые Ф, гормоны, иммуноглобулины), секретируются этими клетками в виде пробелков. Предшественники Ф носят название зимогенов. Последние имеют на N-конце первичной полипептидной цепи специальную сигнальную последовательность, состоящую из 15—20 аминокислотных остатков. После отщепления этой сигнальной последовательности с помощью мембранных протеаз белок активируется не сразу, а по достижении им определенной мишени.
Системы протеаз обеспечивают течение таких важных физиологических процессов, как свертывание крови, регуляция АД, расщепление чужеродных антигенов после их связывания с антителом и др. Нарушение нормального функционирования какого-либо из перечисленных процессов влечет за собой развитие серьезных патологических состояний. В этой связи многие протеазы являются мишенями для биологически активных веществ.
Лиазы. Они катализируют процессы негидролитического расщепления субстрата с образованием кратной связи (реже цикла), либо присоединения по такой связи. Декарбоксилазы катализируют отщепление С02 от карбоновых кислот. Например, образующаяся при спиртовом брожении глюкозы пировиноградная кислота декарбоксилируется под действием пируват декарбоксилазы с образованием уксусного альдегида.
Ферментативным путем происходит декарбоксилирование ряда аминокислот с образованием важных нейромедиаторов. Так, L-глутаминовая кислота под действием глутамат декарбоксилазы превращается в ГАМК. Другой Ф этой же группы — декарбоксилаза ароматических аминокислот — катализирует декарбоксилирование l-(3,4-диоксифенил) - аланина (L-ДОФА), превращая последний в норадреналин.
Изомеразы. Катализируют процессы изомеризации, с помощью которых происходит обращение конфигурации при асимметрическом атоме углерода. Энзим катализирует обращение конфигурации в обоих направлениях, что приводит к образованию рацемической смеси. Такие Ф получили название рацемаз.
При наличии в молекуле нескольких хиральных центров обращение конфигурации при одном из них приводит к образованию диастереомерной пары. Ф, катализирующие такие процессы, называют эпимеразами. Они играют важную роль во взаимопревращениях углеводов.
Следует отметить, что не все биохимические процессы, завершающиеся изомеризацией какого-либо субстрата, катализируют Ф этого класса. Например, превращение лимонной кислоты в изолимонную осуществляется при участии лиазы.
Лигазы (синтетазы). Катализируют реакции конденсации или присоединения, сопряженные с пиролизом одной из пирофосфатных связей в молекуле АТФ или ГТФ.
Ряд лиаз катализируют реакцию конденсации аминокислоты с ОН-группой З'-концевого аденозина в транспортной РНК (тРНК). В результате таких реакций, происходящих с каждой из входящих в состав белков 20 аминокислот, последние оказываются распределенными в строгом соответствии с тРНК. Это имеет решающее значение при сборке белковых молекул на рибосомах, где распознавание осуществляется не по аминокислотным остаткам, а по связанным с ними тРНК.
Принципы действия ферментов. В качестве модели Ф-С взаимодействия более 60 лет просуществовала аналогия «замок — ключ», предложенная в конце XIX в. Fisher. Суть ее в том, что к Ф (замку) подходит лишь свой субстрат (ключ). В 1959 г. Koshland была высказана гипотеза «индуцированного соответствия». Согласно этой общепризнанной в настоящее время модели связывание Ф с соответствующим ему субстратом индуцирует в белке небольшие конформационные изменения. В результате каталитические группы Ф ориентируются таким образом, что становится возможным превращение субстрата в продукт. Модель индуцированного соответствия допускает также некоторую конформационную перестройку в молекуле субстрата, которая получила название напряжения. Гипотеза о возникновении конформационных изменений в Ф и субстрате при их связывании позволяет объяснить тот факт, что молекулы, очень близкие по строению к истинному субстрату, могут связываться с Ф, но при этом не превращаются в продукт, т. е. действуют как ингибиторы.
Скорость (1010–1016) ферментативной реакции зависит от природы реагирующих веществ (субстрата и Ф), их концентраций, температуры (увеличивается до определенного предела, пока не начинается денатурация белка), концентрации коферментов, рН, а также от концентрации активаторов и ингибиторов ферментов.
Структурная функция. Белки входят в структуру биомембран, являются основой цитоскелета (микротрабекулярная сетка, микрофилламенты), межклеточного матрикса (коллаген, эластин) и определенных специализированных тканей (кератины).
Коллаген, наиболее распространенный белок млекопитающих, образует основу сухожилий, костей, кожи, зубов и хрящей. Структурной единицей коллагенового волокна является тропоколлагеновая молекула, состоящая из трех полипептидных цепей, каждая из которых содержит около 1000 аминокислотных остатков. В зависимости от функции коллагена его полипептидные цепи либо идентичны, либо имеют довольно близкие последовательности.
Аминокислотный состав коллагена необычен. Во-первых, примерно одну треть всех остатков составляют остатки глицина, и, во-вторых, имеется большое число остатков пролина. Кроме того, в коллагене встречаются остатки двух аминокислот, обычно не обнаруживаемых в белках,- гидроксипролина и гидроксилизина. Боковые цепи этих аминокислот содержат гидроксильную (ОН) группу, присоединенную к одному из углеродных атомов вместо атома водорода. Гидроксилирование осуществляется специфическими ферментами после включения пролина или лизина в полипептидную цепь коллагена.
Кератин - важный белковый компонент волос, шерсти, ногтей, когтей и перьев. В одной из форм, называемой ос-кератином, в основе структуры полипептидной цепи лежит правая а-спираль. В кератине две, а возможно и три цепи закручиваются одна вокруг другой, образуя некую витую (coiled-coil) структуру, называемую протофибриллой. 11 протофибрилл формируют микрофибриллу, а пучок микрофибрилл - кератиновое волокно. а-Кератины легкорастяжимы, поскольку при вытягивании разрываются водородные связи и полипептидные цепи приобретают β-структурную конформацию. При этом образуются межцепочечные водородные связи и формируются β-слои. Кератины с такой структурой называются β-кератинами.
Регуляторные белки. Во всех клетках экспрессия генов контролируется регуляторными белками, которые связываются с определенным участком ДНК и таким образом стимулируют или подавляют транскрипцию гена. Действие регуляторных белков обратимо и, как правило, требует присутствия лиганда. Постоянно открывают все новые и новые регуляторные белки, в настоящее время известна, вероятно, только малая их часть. Регуляторный белок, который влияет на транскрипцию генов, называют фактором транскрипции. Белок, подавляющий транскрипцию, называют репрессором, а стимулирующий — индуктором образования.
Регуляторные белки, чаще называемые гормонами, участвуют в различных физиологических процессах. Например, гормон инсулин состоит из двух a-цепей, соединенных дисульфидными мостиками. Инсулин регулирует обменные процессы с участием глюкозы, его отсутствие ведет к диабету.
В гипофизе мозга синтезируется гормон, регулирующий рост организма. Существуют регуляторные белки, контролирующие биосинтез различных ферментов в организме. Белковую и пептидную природу имеют многочисленные биорегуляторы – гормоны, медиаторы и модуляторы, которые вырабатываются в эндокринной системе, нейронах головного мозга, иммунной системе: простые белки (инсулин, глюкагон и т. д.), гликопротеины (тропные гормоны гипофиза и др.), низкомолекулярные пептиды (окситоцин, вазопрессин, опиоидные пептиды мозга, пептиди тимоцитов и т. д.).
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 786; Нарушение авторских прав?; Мы поможем в написании вашей работы!