
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закономерности формирования электронных оболочек атомов
|
|
|
|
Распределение электронов в атомах по энергетическим уровням, подуровням и орбиталям соответствует принципу наименьшей энергии, принципу Паули и правилу Хунда.
Принцип наименьшей энергии в общей форме имеет следующую формулировку:
электроны в атоме занимают наиболее низкое энергетическое состояние, соответствующее их максимальной устойчивости.
Конкретным выражением принципа наименьшей энергии является правило Клечковского:
заполнение атома электронами идет от орбиталей с меньшим значением суммы n + l к орбиталям с большим значением этой суммы, а при одинаковой сумме n + l - от меньших к большим значениям главного квантового числа n.
Таким образом, принципу наименьшей энергии соответствует следующая последовательность заполнения энергетических уровней и подуровней (внизу приведена сумма n + l):
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s
1 2 3 3 4 4 5 5 5 6 6 6 7 7 7 7
Графической иллюстрацией принципа наименьшей энергии и правила Клечковского является рис. 7, на котором последовательность заполнения энергетических уровней и подуровней происходит в направлении диагональных стрелок.
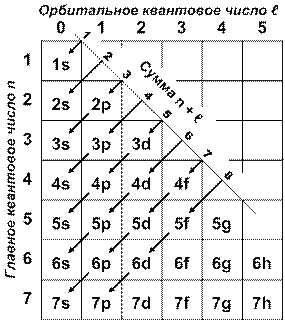
Рис. 7. Последовательность формирования энергетических уровней и подуровней
в электронных оболочках многоэлектронных атомов
Принцип Паули: в атоме не может быть даже двух электронов, имеющих одинаковый набор всех четырех квантовых чисел. Из принципа Паули следует:
1) На одной атомной орбитали, которая характеризуется одинаковыми значениями трех квантовых чисел (n, l и ml), может находиться максимум два электрона, отличающихся спином.
2) На энергетическом уровне может находиться максимум 2n2 электронов: на первом – 2, на втором – 8, на третьем – 18 и т.д.
3) На энергетическом подуровне может находиться максимум 2(2 l + 1) электронов: на s-подуровне (одна орбиталь) – 2, на p-подуровне (три орбитали) – 6, на d-подуровне (пять орбиталей) – 10, на f-подуровне (семь орбиталей) – 14.
Правило Хунда описывает закономерности распределения электронов на энергетических подуровнях в тех случаях, когда для полного их заполнения электронов недостаточно:
в невозбужденном атоме суммарный спин всех электронов по абсолютной величине максимален, а при равенстве суммарного спина наиболее устойчивым является состояние с наибольшей (по абсолютной величине) суммой магнитного квантового числа.
В соответствии с правилом Хунда, атомные орбитали, принадлежащие к одному подуровню, заполняются каждая вначале одним электроном, а затем происходит их заполнение вторыми электронами.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 4301; Нарушение авторских прав?; Мы поможем в написании вашей работы!