
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молекулярные механизмы генных, хромосомных и геномных мутаций 3 страница
|
|
|
|
Под руководством М.Е. Лобашева еще в 60-е годы на кафедре генетики и селекции Ленинградского университета были начаты эксперименты, доказавшие роль нервной системы в контроле частоты хромосомных аберраций в соматических клетках (роговице глаза) у мышей. Развивая это направление, ученики М.Е. Лобашева (Р.И. Цапыгина, С.Н. Новоков, Е.В. Даев) показали мутагенный эффект феромонального стресса у мышей. При этом важно, что речь идет уже о мутациях не в соматических, а в генеративных клетках — при сперматогенезе. Схема проделанного эксперимента представлена на рис. 40.
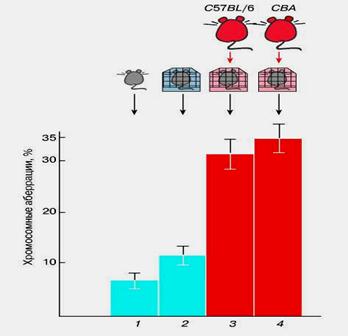
Рис.40. Влияние феромонального стресса на частоту хромосомных аберраций у мышей. Гистограмма показывает частоту аберраций в сперматогенезе: 1 - без дополнительного воздействия; 2 - результат помещения мышей 30-дневного возраста на чистую подстилку; 3,4- результат помещения мышей того же возраста на подстилку после пребывания на ней самцов 3-4-месячного возраста.
Известно, что запах во взаимоотношениях мышей выполняет функции своеобразного языка. Феромоны, летучие вещества, содержащиеся в моче этих животных, играют роль сигналов, вызывающих реакцию подчинения, агрессии и т.д. Пользуясь этими сигналами, старые самцы держат в подчинении самок и молодых самцов. Оказалось, что запах взрослого самца при однократном воздействии повышает частоту цитологических нарушений в сперматогенезе у молодых самцов, увеличивает частоту аномальных сперматозоидов и доминантных летальных мутаций, выявляемых после их спаривания с самками, не подвергавшимися воздействию.
Методы определения мутагенной активности веществ. С некоторых пор (у нас с 1979 года) все новые химические соединения (а всего их в обиходе более 4,5 млн) проходят проверку на генетическую активность. Это своеобразная служба генетической безопасности, использующая богатый арсенал различных тест-систем для выявления генетической активности. Эти системы позволяют учитывать мутации генов, их рекомбинации, потери и другие аберрации хромосом, нарушения делений ядра, индукцию репарации ДНК и т.д. При этом используются различные объекты: бактерии, дрожжи и другие низшие грибы, плодовая мушка-дрозофила, растения, культура клеток животных и человека.
Наибольший интерес представляет генетическая активность исследуемых агентов для человека. Поскольку прямое исследование их действия на человека невозможно, приходится ограничиваться результатами, получаемыми на модельных объектах. Эти результаты в значительной степени справедливы и для человека из-за биологической универсальности свойств генетического материала — это всегда ДНК. Тем не менее экстраполяция получаемых результатов на человека всегда представляет некоторые сложности, так как наряду с принципом биологической универсальности следует учитывать и специфику объектов, имеющих свои особенности реагирования на мутагены.
В качестве примера рассмотрим только одну тест-систему, получившую широкое распространение при первичном выявлении генетической активности. Это система, разработанная в 60-е годы XX века американским исследователем Б. Эймсом, который длительное время изучал мутации в генах, контролирующих биосинтез гистидина у Salmonella typhimuium. Работа Б. Эймса, прекрасный пример того, как первоначально чисто теоретическое исследование, направленное на выяснение структуры и функции гена, приобрела сугубо практическое значение. Имея в своем распоряжении подробно охарактеризованные мутанты сальмонеллы, нуждающиеся в гистидине, зная молекулярную природу мутационных изменений: замены, вставки или выпадения пар оснований в ДНК гена или более крупные перестройки генетического материала, Эймс предложил изучать реверсии гистидиновых мутантов, то есть восстановление у них способности синтезировать гистидин, и, следовательно расти на среде без гистидина в результате воздействия различных мутагенов.
Тест очень прост: достаточно засеять среду без гистидина мутантом сальмонеллы, нуждающимся в гистидине (который естественно не растет на такой среде), и нанести в центр используемой для этого чашки Петри испытуемое химическое соединение. Через 2—3-е суток можно видеть появление колоний мутантов (в данном случае ревертантов) вокруг пятна нанесенного вещества, если оно обладает генетической активностью (рис.41.). Это пример так называемого спот-теста (от англ. spot — пятно). В настоящее время тест Эймса усовершенствован: наряду с хорошо изученными мутациями потребности в гистидине в геном сальмонеллы вводят делецию по одному из генов репарации, то есть инактивируют этот процесс, тем самым повышают чувствительность бактерии к мутагенам. Вводят также мутацию, блокирующую синтез липополисахаридной капсулы для повышения проницаемости клеток, а также плазмиды, повышающие чувствительность клеток к агентам, усиливающим рекомбинацию. Наконец, испытуемое вещество стали наносить вместе с экстрактом мышиной или крысиной печени, содержащим цитохром Р450 для активации про-мутагенов. Таким образом, тест-системы для выявления генетической активности могут быть далее усовершенствованы и в значительной степени генетическими методами. С применением теста Эймса впервые были показаны мутагенные эффекты: сигаретного пепла, некоторых пищевых консервантов, красителей для волос и т.д.
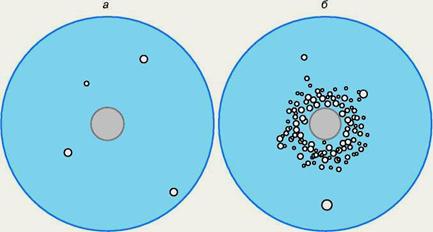
Рис.41. Схема демонстрации мутагенной активности химического соединения - нитрозогуанидина в спот-тесте с использованием системы Б. Эймса: а - контрольная чашка Петри, содержащая среду без гистидина и засеянная культурой мутанта S. typhimurium His, не способного синтезировать гистидин. Вырастают только редкие спонтанные ревертанты His —*• His+. В центр помещен кружок фильтровальной бумаги, смоченный растворителем, но не содержащий мутагена; б - такая же чашка, в центр которой помещен кружок фильтровальной бумаги, смоченный раствором мутагена. Вокруг него появляется кольцо индуцированных мутантов - ревертантов His+.
Обилие химических соединений, которые по мере их появления необходимо проверять на генетическую активность, обусловило разработку простых, надежных и дешевых методов и тест-систем для скрининга, или просеивания, большого числа соединений. Для выявления мутагенов, в этих тест-системах используются различные объекты и различные критерии. В настоящее время генетическая активность веществ определяется по следующим основным критериям: 1) генным мутациям — заменам, вставкам и выпадениям пар нуклеотидов; 2) конверсии и 3) реципрокной, преимущественно митотической, рекомбинации; 4) нерасхождению хромосом в митозе; 5) хромосомным аберрациям; 6) обменам между сестринскими хроматидами. Кроме того, применяют такие критерии, как увеличение частоты доминантных леталей у дрозофилы и мышей и частота аномальных сперматозоидов у мышей. Последние два теста нельзя строго отнести к генетическим, однако их результаты хорошо коррелируют с остальными тестами, основанными на критериях повреждения генетического материала.
В качестве объектов при массовом определении генетической активности тех или иных факторов используют культуры клеток человека и животных, высшие растения, микроорганизмы, дрозофилу.
Антимутагенез. Это понятие включает такие воздействия на клетку и организм, которые блокируют или уменьшают вероятность возникновения мутаций. Подобные воздействия могут стимулировать системы инактивации мутагенов или подавлять системы активации промутагенов, могут стимулировать процессы безошибочной репарации или непосредственно модифицировать мутаген, «отвлекать» его от генетического материала. Кроме того, в организме имеется специальные механизмы, снижающие неблагоприятный эффект мутаций. Во-первых, это способность ДНК-полимеразы осуществлять коррекцию дефектов (на основе комплементарности цепей ДНК) при образовании новых цепей ДНК. Существует также специальный фермент — эндонуклеаза, редактирующая структуру дочерних цепей ДНК. Определенную роль в стабильности генотипа играет избыточность генетического кода, а также диплоидность кариотипа соматических клеток. Парность аллелей (диплоидный набор хромосом) препятствует проявлению рецессивных мутаций. К снижению проявлений вредных мутаций приводит наличие в генотипе нескольких десятков или сотен копий генов (экстракопирование генов), кодирующих жизненно важные белки. Кроме этого существуют специальные молекулярные механизмы репарации.
Антимутагенной активностью обладают радиопротекторы — соединения, способные уменьшать летальный эффект ионизирующей радиации, прежде всего серосодержащие аминокислоты: цистеин, цистин, метионин и др.
Обычно для каждого конкретного мутагена антимутагенная активность специфична, что затрудняет поиски антимутагенов. Генетическую активность N'-метил-N'-нитро-N'-нитрозогуанидина (МННГ) нейтрализует кровь млекопитающих, в которой основным антимутагеном (анти-МННГ) служит гемин. Ненасыщенные жирные кислоты, тониновая кислота и катехин, содержащийся в чае и кофе, некоторые витамины, например а-токоферол, и другие соединения обладают большей или меньшей антимутагенной активностью по отношению к отдельным мутагенам.
К сожалению, разнообразие исследованных соединений и объектов так велико, что не представляется возможным делать какие-либо обобщения о природе антимутагенных эффектов. Кроме того, исследователи обычно не могут контролировать различные этапы становления мутации. Отсутствуют тест-системы, специализированные для поиска антимутагенов.
Обращаясь к проблеме уменьшения генетической опасности, следует помнить, что человеческие популяции гетерогенны по многим признакам, в том числе по реакции на различные воздействия внешних факторов. Это обстоятельство уже учитывает фармакогенетика, изучающая реакцию различных групп людей на лекарственные вещества. Известно, например, что у некоторых больных сульфаниламидные препараты вызывают гемолиз. Это связано с наследственной недостаточностью глюкозо-6-фосфатдегидрогеназы. Есть категория людей с наследственной болезненной реакцией на глюкокортикоиды. При применении этих препаратов у них повышается внутриглазное давление. Нестабильность некоторых мутантных форм гемоглобина сопряжена с гемолизом при применении окислителей.
Известна также наследственная чувствительность к действию некоторых мутагенов и канцерогенов. Например, люди с повышенной активностью арилгидрокарбонгидроксилазы склонны к заболеваниям раком легких в случае контакта с полициклическими углеводородами, которые после гидроксилирования указанным ферментом превращаются в эпоксиды, обладающие высокой канцерогенной активностью.
Эти обстоятельства необходимо учитывать в разных областях человеческой деятельности: при лечении больных, при профессиональном отборе людей, имеющих дело с различными производственными вредностями.
Итак, меры по обеспечению генетической безопасности человека связаны с решением многих проблем, общих для генетики и экологии, и, прежде всего охраны окружающей среды от загрязнения. Генетическая токсикология делает при этом главный акцент на генетически активные факторы.
Генеративные и соматические мутации. В зависимости от «места» мутирования различают: генеративные и соматические мутации. Генеративные — это мутации, возникающие в генетическом аппарате генеративных клеток и передающиеся потомкам при половом размножении (например, изменения кариотипа гаметоцитов при нарушении мейоза).
Эти мутации непосредственно не сказываются на здоровье данного человека, но приводят к рождению потомства с наследственными болезнями. Причинами мутаций в генеративных клетках являются вышеуказанные мутагенные факторы, а также различного рода нарушения мейоза и кроссинговера при гаметогенезе. В зависимости от изменений генотипа половых клеток, а затем зиготы, мутации могут быть генными, хромосомными и геномными.
Геномные мутации. Если в результате какого-либо события происходит изменение числа хромосом в кариотипе, то говорят о геномных мутациях. К ним относятся полиплоидия и гетероплоидия (анэуплоидия).
Полиплоидия — увеличение числа хромосом в 2,3,4 и т. д. раза в результате добавления полных хромосомных наборов из-за нарушений деления. У полиплоидных организмов отмечается увеличение числа хромосом, кратное гаплоидному набору: Зп — триплоид, 4п — тетраплоид, 5п — пентаплоид, и т.д. У растений полиплоиды жизнеспособны и некоторые обладают повышенной урожайностью (более крупные листья, стебли, корнеплоды, плоды, цветки).
Полиплоидия у человека представляет собой летальную мутацию. Например, триплоидия у человека (69 хромосом) является довольно частой спонтанной мутацией набора хромосом в эмбриогенезе. Но большинство таких зародышей погибает на первом месяце развития. До 6-7 месяца развития дожинает 1 %, что обычно заканчивается спонтанными абортами. Иногда такие дети (синдром триплоидии-69, XXY) рождается, но живут только 5-7 дней. Такие дети имеют многочисленные пороки развития: головного мозга, сердца, желудочно-кишечного тракта и др. Причинами полиплоидии являются следствия действия мутагенных факторов, в результате чего в клетках может наблюдаться эндомитоз — удвоение хромосом, но без последующих делений клетки. В результате этого происходит кратное увеличение хромосомных наборов клеток.
Гетероплоидия (анэуплоидия). Вследствие нарушений сложных молекулярных процессов мейоза число хромосом в гаметах может изменяться. Если такие гаметы участвуют в оплодотворении, то образуются аномальные зиготы. Если какая-либо из хромосом в кариотипе организма оказывается в тройном наборе, то это называется трисомией (2п+1), а такой организм называется трисомиком. Трисомия известна у многих видов растений и животных, а также у человека. У человека описаны трисомии для 8,9,13,14,18,21, X и Y. Трисомии только по 21 и Х-хромосомам жизнеспособны, все другие приводят к гибели в первые дни после рождения. Полисомия по Х-хромосоме может доходить до пяти с сохранением жизнеспособности. Примеры трисомии по аутосомам человека: по 21-й хромосоме — синдром Дауна 47, +21; по 18-й хромосоме — синдром Эдвардса; 47, +18; по 13-й хромосоме — синдром Патау 47,+13. Пример анеуплоидии по половым хромосомам: синдром Клайнфельтера 47, XXY (но может быть XXXY, XXYY и другие изменения числа хромосом). При этом люди чаще всего либо нежизнеспособны, либо отличаются пониженной жизнеспособностью и рядом патологических признаков.
 Если в результате нарушения деления одна из хромосом теряется (2п—1), то это явление называется моносомией, а организм моносомным. Анеуплоидия возникает в результате нерасхождения гомологичных хромосом при мейозе. Если отсутствуют две разные хромосомы, то организм является двойным моносомиком (2п—2). Моносомики человека обычно нежизнеспособны. Считается, что около 20 % моносомий заканчивается летально, еще в первые дни эмбрионального развития, остальные погибают на более поздних стадиях. Единственным примером жизнеспособной моносомии у человека является синдром Шерешевского—Тернера — 45, Х0.
Если в результате нарушения деления одна из хромосом теряется (2п—1), то это явление называется моносомией, а организм моносомным. Анеуплоидия возникает в результате нерасхождения гомологичных хромосом при мейозе. Если отсутствуют две разные хромосомы, то организм является двойным моносомиком (2п—2). Моносомики человека обычно нежизнеспособны. Считается, что около 20 % моносомий заканчивается летально, еще в первые дни эмбрионального развития, остальные погибают на более поздних стадиях. Единственным примером жизнеспособной моносомии у человека является синдром Шерешевского—Тернера — 45, Х0.
Геномные мутации всегда проявляются фенотипически и подтверждаются цитогенетическими методами. Таким образом, анэуплоидии, т. е. нарушение нормального числа хромосом, приводят к смерти, различным патологиям или к снижению жизнеспособности организма.
Соматические мутации. Это мутации, происходящие в генетическом аппарате соматических клеток и проявляющиеся только у самой особи (например, рак кожи под действием ультрафиолетовых лучей). Они не передаются потомкам, но могут передаваться дочерним клеткам и оказать существенное влияние на развитие какого-либо из признаков организма. Они вызывают генетические болезни соматических клеток. Генетические болезни соматических клеток выделены в отдельную группу наследственной патологии недавно. Поводом к этому послужило обнаружение при злокачественных новообразованиях специфических хромосомных перестроек в клетках, вызывающих активацию онкогенов (ретинобластома, опухоль Вильмса). Эти изменения в генетическом материале клеток являются этиопатогенетическими для злокачественного роста и поэтому могут быть отнесены к категории генетической патологии. Уже имеются первые доказательства того, что спорадические случаи врождённых пороков развития являются результатом мутаций в соматических клетках в критическом периоде эмбриогенеза. Следовательно, такие случаи можно рассматривать как генетическую болезнь соматических клеток.
Весьма вероятно, что аутоиммунные процессы и старение могут быть отнесены к этой же категории генетической патологии.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1495; Нарушение авторских прав?; Мы поможем в написании вашей работы!