
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изучение диссоциации природных карбонатов
|
|
|
|
ЛАБОРАТОРНАЯ РАБОТА № 1
ПО ТЕОРИИ МЕТАЛЛУРГИЧЕСКИХ ПРОЦЕССОВ
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Цель работы: получить навыки проведения высокотемпературного эксперимента; научиться пользоваться измерительной аппаратурой; получить термограммы диссоциации карбонатов кальция и магния; определить температуры, при которых разложение переходит в кинетический режим; сравнить полученные результаты с теоретическими сведениями.
ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
Карбонатами называются соли угольной кислоты, общая формула карбоната: MeCO3. Наиболее часто в металлургической промышленности применяют известняк (карбонат кальция CaCO3). Также применяются карбонаты магния, железа, марганца. Доломит (Ca,Mg) (CO3)2 используется для изготовления футеровки, наведения шлака. Карбонаты являются рудами некоторых металлов. Как пример, можно привести сидериты – железные руды, состоящие из FeCO3, или руды марганца – родохрозит, содержащие MnCO3. Процесс разложения углекислых солей кальция и магния (мрамор, известняк, доломит) имеет большое значение при операции обжига природных карбонатов, для получения огнеупорных и флюсующих материалов.
Термическая диссоциация карбонатов различных металлов при нагревании происходит по обратимой эндотермической реакции. Карбонаты разлагаются на оксид металла и на диоксид углерода:
MeCO3 = MeO + CO2; ∆H > 0
При этом не образуются твердые растворы, если температура проведения реакции не очень высока (<10000C). Следовательно, состав твердой фазы не принимается во внимание, и система характеризуется двумя переменными: температурой и давлением. Эти переменные не являются независимыми. Действительно, правило фаз показывает, что в трехфазной системе (карбонат, оксид металла, диоксид углерода СО2) с двумя компонентами имеется лишь одна степень свободы:
С = 2 + 2 – 3 = 1
Равновесное состояние подобной системы определяется давлением СО2, которое зависит только от температуры. Поэтому в состоянии равновесия каждой температуре должно соответствовать определенное давление двуокиси углерода, то есть
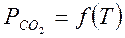 .
.
Равновесное парциальное давление диоксида углерода в реакции диссоциации углекислого соединения называется упругостью диссоциации карбоната.
Константа равновесия реакции диссоциации карбонатов, при условии, что образование твердых растворов не происходит, равна:
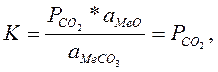
где 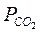 - парциальное давление СО2 в системе;
- парциальное давление СО2 в системе;
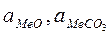 - активности оксида и карбоната соответственно, если оксид металла и карбонат находятся в виде твердых или жидких чистых веществ, то активности их равны 1.
- активности оксида и карбоната соответственно, если оксид металла и карбонат находятся в виде твердых или жидких чистых веществ, то активности их равны 1.
Упругость диссоциации может служить мерой сравнительной прочности карбоната и находится в следующем соотношении с величиной термодинамического изобарного потенциала ∆G (со стандартным изменением энергии Гиббса реакции):
∆G = - R T ln 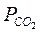 = - R T ln К.
= - R T ln К.
Чем меньше величина ∆G и 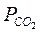 , тем более прочен карбонат, и наоборот. Температурная зависимость константы равновесия выражается уравнением:
, тем более прочен карбонат, и наоборот. Температурная зависимость константы равновесия выражается уравнением:
ln 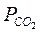 = - ∆G / (R T) = (A / T) + B,
= - ∆G / (R T) = (A / T) + B,
где А и В – числовые коэффициенты, устанавливаемые из опытных данных для определенного температурного интервала.
Для наших условий эти величины составляют:
MgCO3 lg 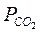 = -
= - 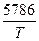 + 6,27 (кПа);
+ 6,27 (кПа);
CaCO3 lg 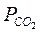 = -
= - 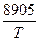 + 7,53 (кПа);
+ 7,53 (кПа);
доломит (первая температурная остановка)
lg 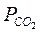 = -
= - 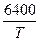 + 8,27 (кПа).
+ 8,27 (кПа).
Прочность наиболее важных карбонатов падает в следующей последовательности: CaCO3→MgCO3→FeCO3. Очевидно, диссоциация карбоната при каждой температуре возможна только в том случае, если парциальное давление двуокиси углерода в окружающей атмосфере будет меньше давления диссоциации карбонатов. Выделяющаяся двуокись углерода повышает 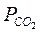 вблизи поверхности карбоната, и реакция может прекратиться, однако, диффузия от поверхности вновь понижает давление СО2 до величин, меньших равновесного, и реакция продолжается. Таким образом, диссоциация протекает в диффузионном режиме. При нагревании карбоната часть подводимой теплоты будет расходоваться на протекание реакции, а другая часть - на нагревание образца. Когда давление углекислого газа сравняется с атмосферным давлением, удаление газа от твердой поверхности будет происходить за счет его оттеснения следующими порциями газа. Реакция переходит в кинетический режим. При этом все тепло тратится на разложение карбоната, то есть реакция будет идти изотермически. Это означает, что на термограмме диссоциации карбоната, построенной в координатах “температура образца - время”, появляется температурная остановка (рис.1).
вблизи поверхности карбоната, и реакция может прекратиться, однако, диффузия от поверхности вновь понижает давление СО2 до величин, меньших равновесного, и реакция продолжается. Таким образом, диссоциация протекает в диффузионном режиме. При нагревании карбоната часть подводимой теплоты будет расходоваться на протекание реакции, а другая часть - на нагревание образца. Когда давление углекислого газа сравняется с атмосферным давлением, удаление газа от твердой поверхности будет происходить за счет его оттеснения следующими порциями газа. Реакция переходит в кинетический режим. При этом все тепло тратится на разложение карбоната, то есть реакция будет идти изотермически. Это означает, что на термограмме диссоциации карбоната, построенной в координатах “температура образца - время”, появляется температурная остановка (рис.1).
Известно, что в воздухе обычно содержится 0,03% СО2, то есть парциальное давление 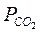 равно 30,4 Па. Для карбоната кальция температура начала разложения на воздухе равна 806К или 5330С, таким образом, на воздухе разложение карбоната кальция, известняка может происходить только при нагреве выше 5330С. Для характеристики диссоциации карбонатов используется понятие температура химического кипения. При этой температуре упругость диссоциации карбоната становится равной общему давлению газа, при котором наступает интенсивное разложение карбоната. Для карбоната кальция температура химического кипения на воздухе при общем давлении 101,3 кПа равна 1183К или 9100С, а для карбоната магния- 923К или 6500С. Различие в температурах можно объяснить тем, что поляризующее действие иона Mg2+ , который имеет меньшие размеры, выше, чем поляризующее действие иона Са2+., поэтому распад
равно 30,4 Па. Для карбоната кальция температура начала разложения на воздухе равна 806К или 5330С, таким образом, на воздухе разложение карбоната кальция, известняка может происходить только при нагреве выше 5330С. Для характеристики диссоциации карбонатов используется понятие температура химического кипения. При этой температуре упругость диссоциации карбоната становится равной общему давлению газа, при котором наступает интенсивное разложение карбоната. Для карбоната кальция температура химического кипения на воздухе при общем давлении 101,3 кПа равна 1183К или 9100С, а для карбоната магния- 923К или 6500С. Различие в температурах можно объяснить тем, что поляризующее действие иона Mg2+ , который имеет меньшие размеры, выше, чем поляризующее действие иона Са2+., поэтому распад 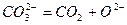 под воздействием иона магния происходит легче, чем под воздействием иона кальция.
под воздействием иона магния происходит легче, чем под воздействием иона кальция.
Доломит представляет собой двойную соль CaMg(CO3)2, и при атмосферном давлении на термограмме диссоциации этого карбоната появляются две температурные остановки: при 1021К или 7480С и около 9100С. На первой стадии процесса образуется оксид магния, но при более высокой температуре, чем при диссоциации чистого карбоната магния, так как ион 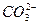 окружен и ионами магния, и ионами кальция. Вторая температурная остановка вызвана разложением карбоната кальция.
окружен и ионами магния, и ионами кальция. Вторая температурная остановка вызвана разложением карбоната кальция.
Кроме температуры на давление диссоциации карбоната влияет степень дисперсности взаимодействующих веществ. Избыточная поверхностная энергия мелкокристаллических веществ по сравнению с крупнокристаллическими обуславливает зависимость их термодинамических свойств не только от температуры, но и от размеров кристаллов оксида и карбоната. Повышение степени дисперсности кристаллов карбоната уменьшает его прочность и соответственно увеличивает равновесное давление 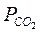 . Мелкодисперсный, тонко помолотый карбонат будет менее устойчивым, он будет легче распадаться. Такой карбонат имеет большую упругость диссоциации, а, следовательно, температурная остановка будет более короткая, и наблюдается при более низкой температуре. Отсюда становится ясным, что при диссоциации полидисперсного карбоната горизонтальные площадки превращаются в наклонные, так как вначале диссоциируют мелкие частицы, а затем – крупные куски.
. Мелкодисперсный, тонко помолотый карбонат будет менее устойчивым, он будет легче распадаться. Такой карбонат имеет большую упругость диссоциации, а, следовательно, температурная остановка будет более короткая, и наблюдается при более низкой температуре. Отсюда становится ясным, что при диссоциации полидисперсного карбоната горизонтальные площадки превращаются в наклонные, так как вначале диссоциируют мелкие частицы, а затем – крупные куски.
 Т
Т
CaCO3 CaMg(CO3)2
τ
Рис.1. Термограммы диссоциации различных карбонатов.
Заметное влияние на процессы диссоциации оказывают примеси, содержащиеся в природных продуктах. Так для разновидностей CaCO3 возрастает температура разложения и понижается упругость диссоциации в следующем порядке:
| кальцит | известняк | мел | мрамор |
| 9100С | 9000С | 9140С | 9210С |
МЕТОДИКА ПРОВЕДЕНИЯ РАБОТЫ
В чугунной ступке отдельно измельчаются доломит и мрамор. С помощью набора сит отбирается монодисперсная фракция заданной крупности (от 1,0 до 3,0 мм) каждого карбоната. Образцы порошков массой около 100 – 150 граммов помещают в два алундовых тигля № 5, которые располагают в центре шахтной печи. Термопары опускаются внутрь объема измельченных карбонатов. Замеры температуры обоих образцов ведут в режиме нагревания печи через каждые 2 или 3 мин. Эксперимент продолжают до температуры печи равной 950- 9700C.
ОБРАБОТКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ
1. По результатам измерений построить интегральные термограммы диссоциации обоих карбонатов в координатах “температура образца - время”. Рисунок сделать на миллиметровой бумаге.
2. По экспериментальным данным определить температуры, при которых происходит переход реакции в кинетический режим, и упругость диссоциации различных карбонатов становится равной одной атмосфере. Температуры указать в градусах Цельсия и в Кельвинах.
3. При работе с карбонатами различной дисперсности сделать выводы о влиянии размеров частиц на процессы диссоциации.
4. Построить дифференциальную термограмму в координатах dT/dτ от τ. Переходя к конечным величинам, следует построение провести в координатах ΔТ/Δτ от τ. Дифференциальная кривая, как известно, позволяет лучше выявить точки перегибов, которые здесь представляются в виде экстремумов.
5. Сравнить полученные результаты с данными, известными из справочной литературы. Обобщить информацию и сделать выводы.
СОДЕРЖАНИЕ ОТЧЕТА
1. Краткие сведения о теоретических основах термической диссоциации карбонатов.
2. Таблица экспериментальных и расчетных результатов.
3. Интегральные термограммы диссоциации карбонатов.
4.* Дифференциальные термограммы диссоциации карбонатов.
5. Выводы по работе.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Назовите важнейшие для металлургии карбонаты.
2. По каким реакциям происходит распад карбонатов?
3. Что такое упругость диссоциации карбонатов?
4. От чего зависит значение упругости диссоциации карбоната?
5. Если 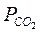 в окружающей атмосфере больше упругости диссоциации при данной температуре, будет ли распадаться карбонат?
в окружающей атмосфере больше упругости диссоциации при данной температуре, будет ли распадаться карбонат?
6. Благоприятствует ли повышение температуры увеличению прочности карбонатов?
7. Как найти давление двуокиси углерода над разлагающимся карбонатом при различных температурах?
8. В каких режимах происходит диссоциация карбонатов?
9. C чем связано наличие температурной остановки на интегральной термограмме диссоциации карбонатов?
10. Как влияет дисперсность частиц карбонатов на величину упругости диссоциации?
11. Как изменится характер термограммы при изменении фракции карбоната?
12. Почему разложение карбоната магния происходит при меньших температурах, чем карбоната кальция?
13. Для чего строится дифференциальная термограмма?
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 3053; Нарушение авторских прав?; Мы поможем в написании вашей работы!