
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методика проведения работы
|
|
|
|
В 0%А
Время 100%А 100%В
IV
Рис. 1. Кривые охлаждения и диаграмма состояния системы с ограниченной растворимостью компонентов в жидком состоянии и не растворимых в твердом. (Диаграмма двойной системы с простой эвтектикой).
Диаграммы состояния строятся с применением различных методов, из которых один из наиболее простых состоит в измерении температуры сплавов в процессе их охлаждения, начиная от жидкого состояния. Результаты таких измерений представляют на графиках температура – время в виде кривых, которые называются кривыми охлаждения. На рис.1 (в левой части) кривая 1 описывает охлаждение расплавленного чистого компонента А.
При его кристаллизации выделяется теплота плавления и в результате температура остается постоянной до окончания затвердевания жидкости. На кривой охлаждения это проявляется в виде площадки. Длительность температурной остановки связана с условиями теплоотвода. После кристаллизации температура начнет вновь падать.
На практике встречается явление переохлаждения, с последующим повышением температуры до Ткристалл.. Кривые охлаждения для двухкомпонентных систем характеризуются наличием не только площадки, но и точки перегиба, изгибом, начало которого соответствует температуре начала кристаллизации одного из компонентов (кривая 2). Однако в отличие от чистого компонента здесь не наблюдается остановки температуры. Это связано с тем, что по мере выделения А расплав обогащается компонентом В и его температура плавления понижается. После излома кривая 2 идет более полого (из-за освобождения тепла кристаллизации), а охлаждение, сопровождающееся дальнейшим выделением А, приводит к непрерывному увеличению концентрации В в остающемся расплаве. Наконец, при некоторой температуре расплав становится насыщенным и относительно В. С этого момента наряду с кристаллизацией А начинается выделение В, то есть расплав затвердевает без изменения своего состава. Поэтому в результате выделения теплоты плавления на кривой охлаждения возникает остановка. Ниже этой температуры кривая 2 передает плавное охлаждение смеси двух твердых фаз. Кривые охлаждения, подобные кривой 2, характерны для всех расплавов, составы которых лежат левее точки Е. Расплав, в точности отвечающий составу этой точки, то есть эвтектический, кристаллизуется подобно чистому компоненту – кривая 3. Кривые охлаждения расплавов, составы которых лежат правее точки Е, соответствуют кристаллизации компонента В и имеют такой же вид, как описанные выше для левой части диаграммы состояния. По кривым охлаждения расплавов с различным содержанием компонентов строится полная диаграмма состояния.
Относительно простой является диаграмма равновесия двухкомпонентной системы, в которой компоненты А и В неограниченно взаимно растворимы в жидком состоянии, а в твердом не образуют ни растворов, ни химических соединений (рис. 1.) По оси абсцисс отложен состав, % (по массе), а по оси ординат – температуры плавления. Температуры ТА и Тв отвечают плавлению чистых компонентов. Жидкий расплав (поле I) характеризуется тем, что можно произвольно изменять его температуру и состав, не вызывая появление новых фаз (число степеней свободы С = 2 – 1 + 1 = 2). Линии ТАЕ и ЕТв и горизонталь ТЕ ЕТЕ ограничивают области (поля II и III), соответствующие моновариантным двухфазным равновесиям (число степеней свободы С = 2 – 2 + 1 = 1). В них заданной температуре соответствует определенный состав жидкости, равновесной с кристаллами компонентов (А или В), и, наоборот, данному составу жидкости соответствует своя температура кристаллизации. Так при температуре Тn состав жидкости, находящееся в равновесии с твердым компонентом А, определяется пересечением горизонтальной прямой, идущей на уровне Тn, с линией ТАЕ, т.е. соответствует точке N.
В поле II существует две фазы - расплав переменного состава, зависящего от Т, и твердый компонент А. Поле III также ограничивает область существования двух фаз - твердого компонента В и расплава переменного состава. Поле IV соответствует механической смеси твёрдых компонентов А и В.
Линии ТАЕ и ЕТв, выше которых существует только жидкость и которые соответствуют началу кристаллизации, называются линиями ликвидуса. Ниже температуры ТЕ полностью исчезает жидкая фаза и в этой зоне существует лишь механическая смесь кристаллов А и В. Прямая ТЕ ЕТЕ называется линией солидуса.
Построение диаграмм состояния по кривым охлаждения иллюстрирует рис.2.
Т Т
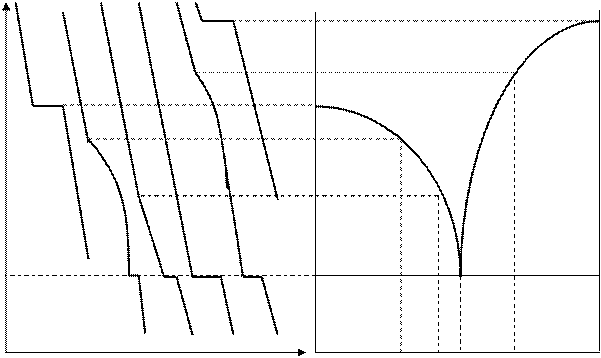 |
1 2 3 4 5 6 Т6
Т5
Т1
Т2
Т3
 ТЕ Е
ТЕ Е
Время А 2 3 4 5 В
Рис.2. Построение диаграммы состояния по кривым охлаждения.
Состав 1 - чистый компонент А. При охлаждении расплава температура монотонно уменьшается до Т1. Остановка (горизонтальный участок на кривой 1) длится до полного завершения кристаллизации.. Дальнейшее охлаждение твердого компонента А описывается плавной кривой.
Состав 2 - расплав содержит компоненты А и В. При охлаждении до температуры Т2. достигается насыщение и начинают выделяться кристаллы чистого компонента А. Процесс охлаждения замедляется (излом на кривой), так как освобождается теплота плавления. В отличие от предыдущего случая, здесь не может быть постоянства температуры при кристаллизации, так как вследствие выделения компонента А расплав непрерывно становится все более концентрированным относительно компонента В, и поэтому температура его замерзания понижается.
При температуре Те концентрация компонента В настолько увеличивается, что расплав становится насыщенным и этим компонентом. Расплав такого состава называется эвтектическим. Ниже Те жидкость полностью исчезает и существует лишь механическая смесь мелких кристаллов А и В, которая образовалась при окончательном затвердевании расплава при Те.. Такая смесь называется эвтектикой.
Состав 3 - кривая охлаждения имеет такой же вид, как для состава 2, с той разницей, что выделение кристаллов компонента А начинается при более низкой температуре, так как по мере повышения концентрации компонента В от состава 2 до 3 температура начала кристаллизации понижается от Т2 до Т3.
Состав 4 - эвтектический. Расплав затвердевает целиком, без изменения состава, при неизменной температуре, подобно чистому компоненту. Эвтектическая точка Е отвечает равновесию трех фаз - одной жидкой и двух твердых, которое изображается уравнением: расплав (состава 4) = АТ + ВТ. Эвтектическая смесь имеет самую низкую температуру плавления из всех сплавов данной системы. При любых других составах эвтектическая составляющая первая начинает выплавляться из любого твердого сплава при его нагревании до Те.
Состав 5 - при охлаждении до температуры Т5 начинается кристаллизация чистого компонента В. По мере выделения В остающаяся жидкость обогащается компонентом А. При температуре Те происходит кристаллизация эвтектики.
Состав 6 - чистый компонент В, кривая охлаждения которого подобна кривой 1. Кристаллизация происходит при постоянной температуре Т6.
Лабораторная установка для изучения кристаллизации двойных металлических расплавов состоит из нагревательного прибора, восьми тиглей с двойными сплавами системы олово-свинец. В сплавы погружены термостойкие чехлы с термопарами. Температура фиксируется с помощью универсального прибора для измерения термоЭДС - Щ4311. Имеется переключатель, позволяющий подключить любую из восьми термопар для регистрации температуры.
Составы изучаемых сплавов приведены в таблице 1:
Таблица 1. Химический состав сплавов системы Pb - Sn
| № сплава | ||||||||
| состав, вес % Pb | 16,25 | 30,38 | 42,80 | 53,78 | 72,36 | 87,47 |
Расплав нагревают до 3500С, после чего отключают нагрев и, в режиме охлаждения, регистрируют температуру металла через каждые 15 сек.
Результата записывают в таблицу 2:
Таблица 2. Экспериментальные данные
| Время, сек. | Показания потенциометра, мв. | |||||||
| I | 2 | |||||||
После кристаллизации фиксируют еще 5-6 значений.
ОБРАБОТКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ
1. На основании полученных данных на миллиметровой бумаге строят кривые охлаждения в координатах: температура (показания потенциометра, мв) - время.
2. По кривым охлаждения составляется таблица 3:
Таблица 3.
| № сплава | Состав | Начало кристаллизации | Конец кристаллизации | |||
| Вес.% | Атом.% | Показания потенциометра, мв | Температура, 0С | Показания потенциометра, мв | Температура, 0С | |
3. Используя данные таблицы, строится диаграмма состояния в координатах: температура - состав (атом. %).
4. Для определения точного состава эвтектической смеси необходимо построить треугольник Таммана. Для этого откладывается на оси абсцисс состав, а по оси ординат - длины горизонтальных отрезков на кривых плавкости. Тогда, соединив их концы, получим прямые линии, абсцисса пересечения которых дает состав эвтектической смеси.
СОДЕРЖАНИЕ ОТЧЕТА
1. Экспериментальные данные показаний потенциометра для сплавов различных составов (таблица 2).
2. Пересчет составов сплавов из значений весовых % в атомные %.
3. Пересчет показаний потенциометра.
4. График кривых охлаждения расплавов различных составов.
5. Диаграмма состояния системы Pb – Sn.
6. Построение треугольника Таммана. Точный состав эвтектической смеси.
7. Выводы по работе.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что называется фазой, составной частью, компонентом, степенью свободы?
2. Какие системы называют гомогенными и гетерогенными?
3. Каковы условия равновесия гетерогенных систем?
4. Как записывают правило фаз Гиббса для различных случаев?
5. Объяснить процессы, протекающие на отдельных участках кривых охлаждения?
6. Что влияет на продолжительность температурной остановки на кривой охлаждения?
7. Как построить диаграмму состояния?
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1051; Нарушение авторских прав?; Мы поможем в написании вашей работы!