
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фазовое равновесие, линия равновесия
|
|
|
|
Рассмотрим процесс массопередачи, в котором аммиак, представляющий собой распределяемый компонент, поглощается из его смеси с воздухом чистой водой.
Обозначим: Фх – жидкая фаза; Фу – газовая фаза; х0 – начальная концентрация аммиака в жидкой фазе; у0 – начальная концентрация аммиака в газовой фазе. Очевидно, что х0 = 0, у0 ≠ 0.
При соприкосновении газа с жидкостью начинается переход аммиака из газовой в жидкую фазу (абсорбция). Скорость этого процесса зависит от концентрации аммиака в воде и на границе раздела фаз: wa = Ka·y (Ka - константа скорости абсорбции).
Скорость обратного процесса – десорбции аммиака – зависит от концентрации аммиака в воде: wд = Kд·х (Kд - константа скорости десорбции).
С течением времени скорость абсорбции будет снижаться, а скорость десорбции – возрастать. В определённый момент скорость абсорбции становится равной скорости десорбции. При этом не будет происходить видимого перехода вещества из фазы в фазу, т.е. установится динамическое равновесие.
В условиях равновесия некоторому значению действующей концентрации аммиака в жидкой фазе х соответствует строго определённая равновесная концентрация в газовой фазе у*. Соответственно, концентрации у соответствует равновесная концентрация х*. В общем виде связь между концентрациями распределяемого вещества в фазах при равновесии выражается: у* = f(х) или х* = f(y’).
Любая из этих зависимостей изображается графически линией равновесия, которая либо является кривой, как показано на рис. 26, либо в частном случае — прямой линией. На рис. 26, а показана равновесная кривая для системы с компонентами - носителями, выражающая зависимость равновесной концентрации, например в газовой фазе, от концентрации жидкой фазы при Р = соnst и t = const. На рис. 26, б приведен пример равновесной кривой для процесса ректификации, построенной при Р = const. Каждая точка кривой, как показано на рисунке, соответствует разным температурам.
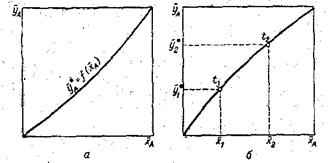
Рис 26. Диаграммы равновесия: а – при р = const и t = const; б – при p = const.
Отношение концентраций фаз при равновесии называется коэффициентом распределения: m = y*/x.
Для разбавленных растворов линия равновесия близка к прямой, и m является практически величиной постоянной, равной тангенсу угла наклона линии равновесия.
Как будет показано ниже, зная линию равновесия для конкретного процесса и рабочие, т. е. неравновесные, концентрации фаз в соответствующих точках, можно определить направление и движущую силу массопередачи в любой точке аппарата. На основе этих данных может быть рассчитана средняя движущая сила, а по ней — скорость процесса массопередачи.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 784; Нарушение авторских прав?; Мы поможем в написании вашей работы!