
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы неэлектролитов. Раствор – гомогенная многокомпонентная система
|
|
|
|
Раствор – гомогенная многокомпонентная система. Для веществ с близкими свойствами и неограниченной взаимной растворимостью понятия “ растворитель” и “ растворенное вещество ” относительны. Например, для системы этиловый спирт – пропиловый спирт растворителем будет считаться тот компонент, количество которого существенно больше. Если в системе присутствует вода, то часто растворителем называют именно ее. При ограниченной взаимной растворимости растворителем считают тот компонент, структуру которого сохраняет раствор.
Растворимостью вещества называется его максимально возможная, равновесная при данной температуре концентрация. В большинстве таблиц она задается в граммах вещества, содержащегося в 100 г растворителя.
Раствор, находящийся в равновесии с растворенным веществом, называется насыщенным. Насыщенный раствор представляет собой гетерогенную систему.
Наиболее часто используемые способы выражения концентрации растворов: массовая доля (часто в виде процентной концентрации) – отношение массы вещества к массе раствора:
w = mвещества/mраствора (*100%);
молярная концентрация C – количество вещества (число молей) n в литре раствора:
С = nвещества/Vр-ра;
моляльная концентрация Cм – количество вещества (число молей) n, приходящееся на 1 кг растворителя:
Cм = nвещества/mрастворителя
Простейшая модель раствора может быть представлена двумя наборами шариков – мелких, моделирующих молекулы растворителя, крупных, моделирующих молекулы (частицы) растворенного вещества (рис. 4):
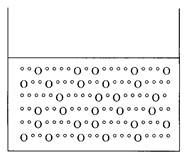
Рис. 4
На основе такой модели можно описать некоторые важные свойства разбавленных растворов неэлектролитов [[11]].
Рассмотрим первую систему.
Сосуд с чистой водой перегородили на две половинки полупроницаемой мембраной – маленькие молекулы воды могут проникать сквозь поры в мембране, а большие молекулы сахара не могут. Потом в правую половину сосуда насыпали сахара (рис. 5).
а) Как изменится скорость проникновения воды слева направо?
б) Как изменится скорость проникновения воды справа налево?
в) Что мы будем наблюдать через некоторое время?

Рис. 5
Решение: обе скорости перехода воды уменьшаются, но справа (где сахар) уменьшается сильнее – молекулы сахара эффективнее “затыкают” отверстия снаружи (справа).
За счет чего выравняются скорости перехода молекул воды? Уровень справа поднимется, и давление увеличит скорость перехода справа налево (рис. 6):
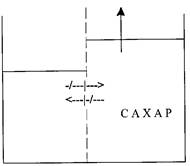
Рис. 6
Явление это называется осмосом (от греч. “осмос” – толчок, давление) [12]. В 1887 г. Вант-Гофф вывел формулу для осмотического давления [[13]]:
p = CRT
Для расчетов удобно пользоваться величиной газовой постоянной R = 0,082 л*атм.
При н.у. осмотическое давление 0,06 М раствора сахарозы составляет 1,34 атм, а условный “объем моля” (по аналогии с идеальным газом) p/С = 22,3; для более концентрированного 1 М раствора давление составляет 24,8 атм, а “объем моля” тоже будет тогда 24,8 (по формуле Вант-Гоффа получается 22,4) [[14]].
Тканевые жидкости млекопитающих имеют p = 6,7-8,1 атм, клеточный сок у растений от 2 атм у болотных до 45 атм у степных. При таких величинах становится понятно, почему хрупкие травинки ломают асфальт. Осмотическое давление крови человека при 370С составляет 7,7 атм (780 кПа); такое давление имеет физиологический раствор (0,9% хлорида натрия)..
Рассмотрим вторую систему в рамках той же простейшей модели.
В сосуде, содержащем воду и лед, поддерживается постоянная температура 00 С. Потом в сосуд насыпали поваренную соль.
а) Как изменится скорость растворения льда?
б) Как изменится скорость кристаллизации воды?
в) Что будет наблюдаться, если и после добавления соли температуру 00 С будут продолжать поддерживать? (рис. 7)
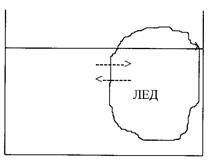
Рис. 7
Решение: стрелки, обозначающие межфазные переходы молекул воды, снова неравномерно уменьшатся. При 00 С лед будет растворяться, поскольку фактором восстановления равновесия является сама температура – она при отсутствии термостатирования понижается из-за продолжающегося таяния льда (Qплавл. = 330 Дж/г) (рис. 8):

Рис. 8
Если в системе хлорид натрия-вода содержтся 22,4% по массе NaCl, то она будет жидкой до -21,20 С. Раствор с 30,22% по массе хлорида кальция замерзает при -49,80 С.
Таким образом, растворенное вещество влияет на температуру замерзания растворителя. Это второй закон Рауля – повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора.
Определение молекулярной массы по понижению температуры плавления при известной массе растворенного вещества в 1000 г растворителя называется криоскопией [[15]].
Dtзам = K Cм = K(g1000)/MG
Cм – моляльная концентрация;
g – масса вещества, растворенного в G граммах растворителя;
M – молекулярная масса растворенного вещества;
K – криоскопическая константа растворителя (для воды 1,853)
В рамках той же модели рассмотрим третью систему.
Замкнутый термостатируемый сосуд частично заполнен водой, остальную его часть занимают только пары воды. Потом в сосуд бросили поваренную соль.
а) Как изменится скорость испарения воды?
б) Как изменится скорость конденсации воды?
в) Как изменится давление в сосуде?
Температура все время постоянна (рис. 9):

Рис. 9
Решение: стрелки, обозначающие межфазные переходы молекул воды, снова неравномерно уменьшатся. Равновесие восстановится за счет понижения давления в системе. Давление пара над раствором всегда ниже, чем над чистым растворителем. Первый закон Рауля(1882 г.) – парциальное давление над раствором прямо пропорционально мольной доле растворенного вещества:
(p0 - p1)/p0 = N
N – мольная доля растворенного вещества, соответствует соотношению количеств модельных “шариков-молекул” (рис. 4)
p0 – давление пара чистого растворителя, p1 – давление пара раствора.
По этой причине температура кипения раствора выше, чем растворителя (при том же давлении). Применение – стакан с солью между оконными рамами предохранит стекла от запотевания.
Определение молекулярной массы по повышению температуры кипения при известной массе растворенного вещества в 1000 г растворителя называется эбуллиоскопией:
Dtкип = E Cм = E(g1000)/MG
Cм – моляльная концентрация;
g – масса вещества, растворенного в G граммах растворителя;
M – молекулярная масса растворенного вещества;
E – эбуллиоскопическая константа растворителя (для воды 0,51)
Общий вывод: мы рассмотрели три варианта установления равновесия в системе чистый растворитель – раствор.
Во всех случаях никакие переходы частиц растворителя не ускоряются, а только замедляются, но неравномерно. При стремлении систем к равновесию достигаются значительные эффекты (осмотическое давление, изменение температуры замерзания и кипения).
Перечисленные выше эффекты можно описать, пользуясь фазовыми диаграммами. Подробный анализ фазовой диаграммы воды с точки зрения правила фаз хорошо изложен профессором О.С.Зайцевым [[16]].

Рис.10 Фазовая диаграмма воды при умеренных давлениях [[17]].
Точка О – тройная точка равновесия газообразного, жидкого и твердого состояний воды. Точка В – критическая точка воды. Кривая ОД соответствует переохлажденной воде.
Методы криоскопии и эбуллиоскопии фактически являются следствием из закона Рауля, что можно отразить на фазовой диаграмме воды (рис.11).

Рис. 11 Изображение зависимости давления пара от температуры [[18]].
1 – кривая для чистого жидкого растворителя; 2 – кривая для чистого твердого растворителя; 3, 4,5 – давление пара растворителя над растворами с увеличивающейся концентрацией нелетучего вещества.
Если раствор состоит из двух летучих компонентов, его можно разделить на составляющие посредством перегонки. Суть процесса в простейшем случае (закон Рауля соблюдается для обоих компонентов во всем диапазоне концентраций) отображена на рис. 12.
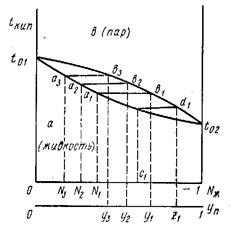
Рис. 12 Зависимость температуры кипения жидкого раствора от состава жидкости N и состава пара У [[19]].
При нагревании до кипения (точка а1) раствора состава N1 первая порция пара будет иметь состав, соответствующий точке b1, т.е. У1. Полученный конденсат будет обогащен более летучим компонентом, а остающийся раствор обогатится менее летучим компонентом. При последовательных шагах от точек с индексом 1 до точек с индексом 3 и далее влево мы получим почти чистый малолетучий компонент и сконденсированные фракции пара, обогащенные летучим компонентом. Повторяя процедуру с конденсатом пара, можно в итоге разделить раствор на чистые компоненты.
В реальных системах часто наблюдаются отклонения от закона Рауля, и на диаграммах температура кипения - состав возникают максимумы и минимумы. Они соответствуют случаю, когда состав пара и жидкости одинаков (нет промежутка ab); смеси, кипящие при постоянной температуре, называются азеотропными. Наиболее известная азеотропная смесь – этанол-вода, кипит при 78,170С, содержит 96% этанола, в то время как чистый этанол (100%) кипит при 78,30С. Такую смесь нельзя разделить перегонкой, и для получения 100%-ного безводного спирта используют другие методы.
Правило фаз сформулировал Дж.У.Гиббс в 1876 г.
Для системы, находящейся в равновесии, сумма числа фаз (Ф) и числа степеней свободы (С) больше числа компонентов (К) на 2:
Ф + С = К + 2
На фазовой диаграмме воды (рис.10) есть точка тройная точка О, в которой число степеней свободы С = 0. В этой точке присутствуют все три фазы в однокомпонентной системе. Одной степени свободы соответствует кривая ОВ, разделяющая две фазы – в системе можно менять либо температуру, либо давление (второй параметр зависит от первого). В однофазном поле, например поле жиlкости СОВ, можно независимо менять и температуру, и давление – система имеет две степени свободы.
[1]. Бенуа Поль Эмиль Клапейрон (1799-1864) - французский физик и инженер, в 1834 г. вывел уравнение состояния идеального газа, которое обобщил в 1874 г. Д.И.Менделеев
[2]. Иоханнес Дидерик Ван дер Ваальс (1837-1923) - нидерландский физик, в 1873 г. вывел уравнение состояния реального газа
[3]. теорию метода разработал нем. физик Макс Феликс Теодор фон Лауэ (1879-1960), первый анализ структуры (сфалерита ZnS) выполнили Генри Брэгг (1862-1942) и Лоуренс Брэгг (1890-1971).
[4]. Общая химия под ред. Соколовской Е.М. и Гузея Л.С., М., 1989
Глинка Н.Л. Общая химия: Учебное пособие для вузов. - издание 15 и следующие. - Л., 1983
[5] Лауреаты "шнобелевской" (Ig Nobel Prize (от английского ignoble - "постыдный", "позорный")) премии 2005: http://www.newsru.com/world/07oct2005/ignobel.html#1 (http://www.anekdot.ru/a/an0510/o051008;10.html)
[6]. Золотухин И.В. Аморфные металлы В: Современное естествознание: Энциклопедия в 10 т. - М.: Флинта: Наука, 1999-2000., т.1. Физическая химия. - 328 с.
[7]. PC-magazine Алфред Пур Плоскопанельные дисплеи: методы изготовления http://www.pcmag.ru/?ID=183791
[8]. Химическая энциклопедия: В 5 т. – М.: Большая Российская энцикл.., 1998.
[9]. Хохлов А.Р. Восприимчивые гели СОЖ, № 11,1998 http://en.edu.ru/db/journals/article/2494/2494.pdf
[10]. Общая химия: Учебник/Под.ред. Е.М.Соколовской и Л.С.Гузея. - 3-е изд. - М.: Изд-во Моск. ун-та, 1989. - 640 с., с.25
[11]. Приведенные ниже примеры задач на перенос через поверхность раздела фаз составлены старшим преподавателем СУНЦ МГУ А.М.Галиным
[12]. Термин ввел французский биолог Анри Дютроше (1776-1847) в 1826 г. Систематические измерения осмотического давления выполнил в 1877 г. немецкий химик и ботаник Вильгельм Пфеффер (1845-1920).
[13]. В 1901 г. первую Нобелевскую премию по химии получил нидерландский ученый Якоб Хендрик Вант-Гофф (1852-1911) - "за открытие законов химической динамики и осмотического давления в растворах".
[14]. Киреев В.А. Краткий курс физической химии - М.: "Химия", 1970. - 640 с., с.30
[15]. Метод предложил в 1885 г. французский физик и химик Франсуа Мари Рауль (1830-1901)
[16]. Зайцев О.С. Вода и диаграмма состояния воды http://him.1september.ru/2003/28/22-1.htm
[17]. Еремин Е.Н. Основы химической термодинамики. Учеб. пособие для вузов. - М.: "Высш. школа", 1974. - 341 с., с.108
[18]. Еремин Е.Н. Основы химической термодинамики, с.283
[19]. Еремин Е.Н. Основы химической термодинамики, с.27
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 725; Нарушение авторских прав?; Мы поможем в написании вашей работы!