
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные процессы. Активность и ионная сила
|
|
|
|
Активность и ионная сила
Произведение растворимости
Для слабо растворимых или “нерастворимых” веществ в справочных таблицах приводят величины ПР. Считается, что малорастворимые соли могут переходить в раствор только в виде ионов:
AKтв «A– + K+
Тогда Кр = [A–][ K+]/[AKтв]; при постоянной температуре [AKтв] постоянна,
тогда Kр[AKтв] = ПР = [A–][ K+]
При строгом термодинамическом рассмотрении (концентрации заменены активностями) принимаем активность чистого твердого вещества равной 1 (см. лекция 3, таблица 1) и получаем то же выражение ПР = [A–][ K+].
Для соли Ca3(PO4)2:
Ca3(PO4)2 «3 Ca2+ + 2 PO43-
ПР = [Ca2+]3[PO43-]2
Поскольку постоянная при tпост величина ПР выражает равновесие, при добавлении избытка одного из ионов, входящих в формулу, концентрация второго иона должна понизиться.
Измеримые свойства растворов сильных электролитов указывают на формально неполную диссоциацию последних. Это связано с электростатическим (кулоновским) взаимодействием между окруженными сольватными оболочками ионами. Поэтому при строгой записи всех приведенных выше формул надо пользоваться не концентрациями, а активностями электролитов a: a = fC f – коэффициент активности.
Для определения f нужно вычислить ионную силу раствора I = 0,5SCмn2,
где Cм – моляльная концентрация иона, а n – его заряд.
-lgf = 0,502 n2(I)1/2 (уравнение Дебая-Гюккеля)
Стандартная процедура: «уравнивание» окислительно-восстановительных реакций (обычно используется метод электронного или электронно-ионного баланса).
Демонстрации:
а) перманганат калия в нейтральной, кислой и щелочной среде
нейтральная среда (Mn+7 ® Mn+4)
2 KMnO4 + H2O + 3 Na2SO3 = 2 MnO2 + 2 KOH + 3 Na2SO4
кислая среда (Mn+7 ® Mn+2)
2 KMnO4 + 3 H2SO4 + 5 K2SO3 = 2 MnSO4 + 3 H2O + 6 K2SO4
2 KMnO4 + 5 SO2 + 2 H2O = 2 MnSO4 + K2SO4 + 2 H2SO4
щелочная среда (Mn+7 ® Mn+6)
2 KMnO4 + 2 KOH + Na2SO3 = 2 K2MnO4 + H2O + K2SO4
Перенос электронов в ОВР реален и используется для практических целей.
Демонстрации:
а) энергия обменной реакции (порошок магния и хлорной меди в присутствии воды).
б) элемент Даниэля [[7]] (Zn + CuSO4 = ZnSO4 + Cu)
При проведении на раздельных электродах реакции вытеснения цинком меди из раствора:
Zn + CuSO4 = ZnSO4 + Cu или Zn + Cu2+ = Zn2+ + Cu
можно использовать электрический ток, возникающий между электродами, для выполнения работы.
В справочных таблицах приводят стандартные электродные потенциалы ряда металлов, показывающие возможность переноса электронов между ними. Эти данные получены для систем, содержащих водный раствор ионов металла с концентрацией (активностью) 1 М и электрод из этого металла; электрический потенциал Е определяется относительно стандарта – водородного электрода. Значения стандартных потенциалов даются для процесса восстановления (принятия электронов) в расчете на один перенесенный электрон.
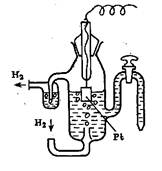
Рис. 1 Водородный электрод. Концентрация Н+ в растворе 1 М, давление Н2 – 1 атм.
Потенциал системы из двух металлов вычисляется по таблицам.
Для системы Zn + Cu2+ = Zn2+ + Cu
Е0 = Е0(ок-ль) - Е0(восст-ль) = +0,34 - (-0,76) = 1,1 В
Для определения направления окислительно-восстановительной реакции пользуются расширенными таблицами стандартных электродных потенциалов.
| Полуреакция(восстановление окисленной формы) | E0, В |
| F2 + 2 e– = 2 F– | +2,87 |
| MnO4– + 8 H+ + 5 e– = Mn2+ + 4 H2O | +1,52 |
| Cl2 + 2 e– = 2 Cl– | +1,36 |
| Cr2O72– + 14 H+ + 6 e– = 2 Cr3+ + 7 H2O | +1,35 |
| Br2 + 2 e– = 2 Br– | +1,07 |
| NO3– + 4 H+ + 3 e– = NO + 2 H2O | +0,96 |
| Ag+ + e– = Ag | +0,80 |
| NO3– + 2 H+ + e– = NO2 + 2 H2O | +0,78 |
| Cu2+ + 2 e– = Cu | +0,34 |
| SO42- + 4 H+ + 2 e– = SO2 + 2 H2O | +0,20 |
| SO42- + 8 H+ + 8 e– = S2- + 4 H2O | +0,15 |
| 2 H+ + 2 e– = H2 | |
| Pb2+ + 2 e– = Pb | -0,13 |
| Fe2+ + 2 e– = Fe | -0,44 |
| Zn2+ + 2 e– = Zn | -0,76 |
| Al3+ + 3 e– = Al | -1,67 |
| Mg2+ + 2 e– = Mg | -2,34 |
| Na+ + e– = Na | -2,71 |
| Ca2+ + 2 e– = Ca | -2,87 |
| K+ + e– = K | -2,92 |
| Li+ + e– = Li | -3,02 |
Пример 1:
Какая реакция пойдет в кислой среде при концентрациях 1 моль/л: окисление Cl– до Cl2 азотной кислотой, которая восстановится до NO, или окисление NO2 до азотной кислоты хлором?
Решение: В ряду потенциалов: Cl2 + 2 e– = 2 Cl– E0 = +1,36 В
NO3– + 4 H+ + 3 e– = NO + 2 H2O E0 = +0,96 В
NO3– + 2 H+ + e– = NO2 + 2 H2O E0 = +0,78 В
Чем выше потенциал присоединения электрона (больше +), тем сильнее окислитель (в уравнении слева). Значит, хлор будет окислять NO2:
Cl2 + 2 NO2 + 2 H2O = 2 HNO3 + 2 HCl
Пример 2:
Пользуясь таблицей стандартных электродных потенциалов, обсудите возможность взаимодействия между серной кислотой и бромидом калия.
Решение: Стандартные потенциалы 1 М серной кислоты как окислителя (+0,20 В и + 0,15 В) ниже, чем потенциал брома, как окислителя (+1,07 В). Следовательно, в 1 М растворе бром может окислить сульфиты и сульфиды до сульфатов, но серная кислота не будет окислять бромид. Если же сухой бромид калия поместить в концентрированную серную кислоту, будет выделяться бром:
3 H2SO4 + 2 KBr = 2 KHSO4 + SO2 + Br2 + 2 H2O
Следовательно, концентрированная серная кислота – более сильный окислитель, чем бром, ее фактический потенциал выше 1,07 В. Предсказания на основе стандартных потенциалов действительны только для водных 1 М растворов.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 453; Нарушение авторских прав?; Мы поможем в написании вашей работы!