
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Математические модели химических процессов с противоположностями
|
|
|
|
Процессы, которые при одних и тех же условиях могут идти как в ту, так и в другую сторону, называются обратимыми или двусторонними.
Характерная особенность обратимых реакций заключается в том, что они не доходят до конца, если продукты реакции не удаляются из сферы взаимодействия.
Химическое равновесие достигается тогда, когда скорость прямой реакции становится равной скорости обратной реакции: создается впечатление, что реакция остановилась, но это впечатление только кажущееся, так как обе реакции продолжают идти, но одна из них сводит на нет результаты другой.
Так как химическое равновесие обуславливается не прекращением реакции, а равенством скоростей двух противоположных процессов, то оно является по существу равновесием динамическим.
Выразим условие наступления равновесия в математической форме.
Предположим, что происходит обратимая реакция, выражающаяся общим уравнением:
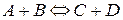 ,
,
где 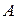 и
и  - два вещества, из которых образуются два новых вещества
- два вещества, из которых образуются два новых вещества  и
и  . Обозначим концентрации этих веществ соответственно через
. Обозначим концентрации этих веществ соответственно через  ,
,  ,
,  и
и  . Скорость прямой реакции обозначим через
. Скорость прямой реакции обозначим через 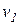 , скорость обратной реакции обозначим через
, скорость обратной реакции обозначим через  . В связи с тем, что скорость реакции пропорциональна произведению концентраций реагирующих веществ, то для прямой реакции
. В связи с тем, что скорость реакции пропорциональна произведению концентраций реагирующих веществ, то для прямой реакции
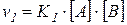 .
.
Точно так же для обратной реакции
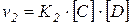 .
.
При установившемся равновесии скорости обеих реакций равны, т.е.
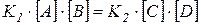 .
.
Преобразуя это уравнение, получаем:
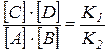 .
.
Так как  и
и  постоянные величины, то их отношение тоже постоянная величина. Обозначим ее буквой
постоянные величины, то их отношение тоже постоянная величина. Обозначим ее буквой 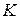 , получим:
, получим:
 ,
,
где  ,
,  ,
,  и
и  обозначают концентрации соответствующих веществ при равновесии.
обозначают концентрации соответствующих веществ при равновесии.
Постоянная величина 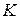 называется константой равновесия. Это характерная для каждой реакции величина, не зависящая от концентраций, но изменяющаяся с температурой. Физический смысл ее нетрудно понять, если принять во внимание, что она равна отношению
называется константой равновесия. Это характерная для каждой реакции величина, не зависящая от концентраций, но изменяющаяся с температурой. Физический смысл ее нетрудно понять, если принять во внимание, что она равна отношению 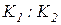 и, следовательно, показывает, во сколько раз отличаются скорости прямой и обратной реакций при одинаковой температуре и концентрациях, равных единице.
и, следовательно, показывает, во сколько раз отличаются скорости прямой и обратной реакций при одинаковой температуре и концентрациях, равных единице.
Выведенное уравнение является математическим выражением закона действия масс применительно к обратимым реакциям.
Как видно из приведенного математического описания здесь используется модель амбивалентной системы с двумя состояниями, в которой интенсивности переходов (скорости прямой и обратной реакции) пропорциональны концентрациям состояний.
Если рассматривается математическая модель химического процесса с учетом образования промежуточного продукта (амбивалентная система с тремя состояниями), который в одной реакции образуется, а в другой - расходуется, то стационарность или постоянство концентрации можно описать с помощью параметра S.
Пусть одним из уравнений математической модели рассматриваемого процесса является уравнение для скорости 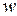 изменения концентрации какого-то промежуточного продукта, причем
изменения концентрации какого-то промежуточного продукта, причем  , где
, где  - скорость образования, а
- скорость образования, а  - скорость расходования этого продукта.
- скорость расходования этого продукта.
В стационарном состоянии скорости образования и расходования промежуточного вещества должны быть равны. Если они не очень сильно различаются, то такое состояние будет близко к стационарному состоянию, которое принято называть квазистационарным. Для анализа условий его выполнимости вводится некий параметр S, равный отношению скоростей распада и образования вещества:
 .
.
При равенстве скоростей реакций получим строгое равенство S =1, т.е. стационарность. В соответствии с теорией амбивалентных систем имеет место вариант «мягкого» гомеостаза, когда интенсивности перехода одной противоположности в другую равны.
На основе методологии амбивалентных систем были предложены конкретные математические уравнения для рассмотренных выше химико-технологических процессов, краткое описание которых приведено ниже.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 571; Нарушение авторских прав?; Мы поможем в написании вашей работы!