
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинаміка
|
|
|
|
Контрольні питання
1 Які фазові переходи називають фазовими переходами першого роду?
2 Що називається питомою теплотою плавлення? Які одиниці ії вимірювання?
3 Записати і пояснити формулу теплоти, яка виділяється при охолодженні сплаву.
4 Накреслити криву залежності температури від часу для випадку кристалізації і пояснити ії
5 Закон Дюлонга і Пті.
6 Залежність теплоємності від температури. Температура Дебая.
ЛІТЕРАТУРА
1. І.М..Кучерук, І.Т.Горбачук, П.П.Луцик ”Загальний курс фізики” т.1. – К. „Техніка” 1999.
2. М.О. Галущак і ін. „Курс фізики. Основи молекулярної фізики і термодинаміки” – К. ІСЛОУ,1993.
П.П.Зарин „Загальна фізика. Конспект лекцій”. – Факел, 2003
. Додаток А.
Коефіцієнт поверхневого натягу рідини при 20 ºС ( )
)
| Вода | 0,073 | Ртуть | 0,500 |
| Мильна вода | 0,040 | Спирт | 0,022 |
Густини речовин 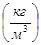
Гази за нормальних умов
| Азот | 1,251 | Кисень | 1,429 |
| Повітря | 1,293 | Вуглекислий газ | 1,977 |
| Водень | 0,090 | Гелій | 0,18 |
Рідини
| Спирт | 0,8∙103 | Гліцерин | 1,26∙103 |
| Гас | 0,8·103 | Ртуть | 13.6∙103 |
| Масло | 0,9∙103 | Вода | 1,0∙103 |
Тверді тіла
| Чавун | 7,0∙103 | Нікель | 8,8∙103 |
| Залізо | 7,8∙103 | Срібло | 10,5∙103 |
| Сталь | 7,8∙103 | Свинець | 11,3∙103 |
| Латунь | 8,4∙103 | Цинк | 7,0∙103 |
| Мідь | 8,9∙103 | Лід | 0,9∙103 |
3.
1. Параметри стану системи:
а) температура, тиск, об’єм, концентрація;
б) температура, ентальпія, ентропія, об’єм;
в) температура, концентрація, внутрішня енергія, вільна енергія;
г) тиск, концентрація, ентропія.
2. Функції стану системи:
а) внутрішня енергія, тиск, ізобарно-ізотермічний потенціал, ентропія;
б) внутрішня енергія, ентропія, температура, тиск;
в) ентропія, ентальпія, енергія Гіббса, температура;
г) внутрішня енергія, ентальпія, ентропія, вільна енергія.
3. Тепловий ефект хімічних реакцій:
а) кількість тепла, що виділяється чи поглинається при протіканні хімічної реакції;
б) кількість тепла, що виділяється при протіканні хімічної реакції;
в) кількість тепла, що поглинається при протіканні хімічної реакції;
г) кількість тепла, що затрачається на роботу.
4. Ізобарно-ізотермічний потенціал (енергія Гіббса) показує, що реакція може самовільно протікати в сторону утворення продуктів реакції, якщо:
а) DG=0; б) DG>0; в) DG<0; г) DН<0.
5. Стандартні умови визначаються наступними значеннями тиску і температури:
а) 101,3 кПа, 273 К; б) 101,3 кПа, 298 К;
в) 101,3 кПа, О К; г) 100,0 кПа, 273 К;
д) 100,0 кПа, 298 К.
6. Для якої з речовин стандартна теплота утворення (ΔН°298) рівна нулю:
а)СО2; б)Н2О; в) Н2; г) CO.
7. При складанні теплових балансів хімічних процесів часто неможливо експериментальне визначити тепловий ефект процесу. В цьому випадку для розрахунків застосовують закон:
а) Нернста; б) Рауля; в) Гесса;
г) Фарадея; д) Вант-Гоффа.
8. За ізобарно-ізотермічних умов критерієм напрямку реакції є зниження:
а) енергії Гельмгольца; б) ентропії;
в) внутрішньої енергії; г) енергії Гіббса;
д) ентальпії процесу.
9. Ентропія, як одна з основних термодинамічних функцій, є мірою:
а) внутрішньої енергії системи;
б) повної енергії системи;
в) енергії, яку не можна використати для виконання роботи;
г) енергія, яку можна використати для виконання роботи;
д) ентальпії.
10. Закон Гесса встановлює, що тепловий ефект хімічної реакції:
а) залежить від природи вихідних речовин;
б) залежить від природи продуктів речовин;
в) не залежить від природи вихідних речовин;
г) не залежить від шляху перебігу реакції.
11. Ентропія ідеально утвореного кристалу індивідуальної речовини при абсолютному нулі:
а) дорівнює одиниці; б) дорівнює нулю; в) від'ємна; г) мінімальна; д) максимальна.
12.Яка термодинамічна функція є критерієм самочинного перебігу реакції в закритому автоклаві при сталому тиску:
а) енергія Гіббса; б) ентальпія; в) ентропія;
г) енергія Гельмгольца; д) внутрішня енергія.
13. При сталому тиску і сталій температурі критерієм самочинного перебігу реакції є:
а) енергія Гіббса; б) ентальпія; в) ентропія;
г) енергія Гельмгольца; д) внутрішня енергія.
14. Критерієм напрямку фізико-хімічних процесів є зменшення енергії Гіббса. При яких сталих факторах цей параметр дійсний:
а) температури і об'єму; б) температури і тиску;
в) маси і теплоємності; г) тиску і об'єму; д) температури і маси.
15. Часто неможливо визначити тепловий ефект процесу. В такому випадку для розрахунку застосовують закон:
а) Вант-Гоффа; б) Гесса; в) Нернста;
г) Рауля; д) Фарадея.
16. Ентропія системи зменшується в процесі:
а) полімеризації; б) плавлення;
в) випаровування; г) сублімації;
д) дисоціації.
17. Енергія Гіббса є мірою:
а) внутрішньої енергії системи; д) ентальпії;
б) розсіяної енергії; г) повної енергії;
в) енергії, яку можна використати для використання роботи;
18. Для закритої системи термодинамічної системи перший закон термодинаміки має вираз:
a) ∆U = Q; б) ∆U = -A; в) ∆U = 0;
*г) Q =∆U + А
19. При яких значеннях термодинамічних функцій можна визначити рівноважну температуру процесу:
а) ∆Н° = 0; б) ∆S° = 0; в) ∆G0 = 0;
г) ∆Н° = 0 і ∆S° = 0; д) правильної відповіді немає.
20. Обов'язковою умовою самочинного протікання процесу є:
а) ∆Н°>0; б) ∆Н°<0; в) ∆S° > 0;
г) ∆S° < 0; д) ∆G0 < 0.
21. Для рівноважних хімічних процесів характерним є таке значення термодинамічних функцій:
а) ∆Н°>0; б) ∆S°<0; в) ∆Н° = 0;
г) ∆G° = 0; д) ∆S° > 0.
22. При стандартних умовах одиницею вимірювання ентальпії є:
а) кДж/моль; б) Дж/моль;
в) Дж/моль-К; г) Дж/моль-м2.
23. В якому з наведених нижче значень реакція можлива при будь якій температурі:
а) ∆Н > 0, ∆G > О, ∆S > 0; б) ∆Н < 0, ∆G > 0, ∆S < 0;
в) ∆Н < 0, ∆G < 0, ∆S > 0; г) ∆Н > 0, ∆G > О, ∆S < 0;
д) ∆Н > 0, ∆G < 0, ∆S > 0.
24. В якому з наведених нижче значень реакція не можлива при будь якій температурі:
а) ∆Н > 0, ∆G > О, ∆S > 0; б) ∆Н < 0, ∆G > 0, ∆S < 0;
в) ∆Н < 0, ∆G < 0, ∆S > 0; г) ∆Н > 0, ∆G > О, ∆S < 0;
д) ∆Н > 0, ∆G < 0, ∆S > 0.
25.Ентальпія – це:
а) термодинамічна функція, що чисельно характеризує міру перетворення енергії в тепло;
б) функція стану чисельно рівна сумі внутрішньої роботи системи і енергії роботи по зміні об’єму системи;
в) це зміна внутрішньої енергії системи, що виражає її тепловміст;
г) параметр стану системи, що виражає зміну внутрішньої енергії системи;
26. Ентропія – це:
а) міра імовірності і функція стану системи;
б) міра хаотичності частинок речовин;
в) частина енергії, що не може бути перетворена в роботу;
г) все разом.
Перший закон термодинаміки:
а) закон збереження енергії;
б) всі види енергії переходять один в одного в еквівалентних кількостях;
в) теплота витрачається на зміну внутрішньої енергії системи;
г) теплота витрачається на виконання роботи проти зовнішніх сил.
Ізобарно-ізотермічний потенціал (енергія Гіббса) показує, що реакція може самовільно протікати в сторону утворення продуктів реакції, якщо:
а) DG<0; б) DG>0; в) DG=0; г) DН<0.
Закон Гесса:
а) Сумарний силовий ефект визначається початковим і кінцевим енергетичним станом речовин і не залежить від шляхів переходу або проміжних стадій;
б) Сумарний силовий ефект визначається початковим і кінцевим енергетичним станом речовин і залежить від шляхів переходу або проміжних стадій;
в) тепловий ефект реакції визначається кількістю теплоти, що виділяється в результаті реакції;
г) тепловий ефект реакції визначається кількістю теплоти, що поглинається в результаті реакції.
45. Живий організм – це термодинамічна система:
а) ізольована, гетерогенна;
б) закрита, гомогенна;
в) відкрита, гетерогенна;
г) відкрита, гомогенна.
46. Абсолютний запас внутрішньої енергії системи:
а) неможливо визначити;
б) визначається як сума всіх видів енергії;
в) визначається за температурою системи;
г) визначається як різниця всіх видів енергії.
47. Процес, який відбувається за сталої температури:
а) круговий;
б) ізотермічний;
в) ізобарний;
г) ізохорний.
48. Процес, який відбувається за сталого тиску:
а) круговий;
б) ізотермічний;
в) ізобарний;
г) ізохорний.
49. Процес, який відбувається при постійному об’ємі системи:
а) круговий;
б) ізотермічний;
в) ізобарний;
г) ізохорний.
50. Математичний вираз 1 закону термодинаміки:
а) Q = ∆U + A;
б) ∆U = U2 – U1;
в) A = p∆V;
г) Q = A - p∆V.
51. Стандартне значення ентальпії реакції (∆Н298) можна розрахувати:
а) Як різницю стандартних значень кінцевих продуктів реакції і вхідних;
б) як суму стандартних значень кінцевих продуктів реакції і вхідних;
в) Як різницю стандартних значень кінцевих продуктів реакції і вихідних речовин;
г) як суму стандартних значень кінцевих продуктів реакції і вихідних речовин.
52. Значення ентальпії чисельно визначається рівнянням:
а) Н = U + pV;
б) ∆U = U2 – U1;
в) Q = ∆U + A;
г) ∆H = H2 – H1.
53. Тепловий ефект хімічної реакції визначається термодинамічною функцією:
а) ентальпією;
б) ентропією;
в) ізоберно-ізотермічним потенціалом;
г) внутрішньою енергією.
54. Термодинамічна система ізольована за умови, якщо:
а) обмінюється з навколишнім середовищем тільки енергією;
б) не обмінюється з навколишнім середовищем ні енергією ні речовиною;
в) обмінюється з навколишнім середовищем і енергією і речовиною;
55. Термодинамічна система закрита за умови, якщо:
а) обмінюється з навколишнім середовищем тільки енергією;
б) не обмінюється з навколишнім середовищем ні енергією ні речовиною;
в) обмінюється з навколишнім середовищем і енергією і речовиною;
56. Термодинамічна система відкрита за умови, якщо:
а) обмінюється з навколишнім середовищем тільки енергією;
б) не обмінюється з навколишнім середовищем ні енергією ні речовиною;
в) обмінюється з навколишнім середовищем і енергією і речовиною.
57. Розчин натрій хлориду містить компонентів:
а) 1; б) 2; в) 3; г) 4.
58 Водно-спиртовий розчин йоду містить компонентів:
а) 1; б) 2; в) 3; г) 4.
59. Суміш, що складається з водного розчину NaCl, кусків льоду, кристалів NaCl, містить фаз:
а) 1; б) 2; в) 3; г) 4.
60. Фізична величина, що не є параметром термодинамічної системи:
а) P; б) V; в) Q; г) T.
61. Фізична величина, що не є параметром термодинамічної системи:
а) P; б) V; в) A; г) T.
62. Фізична величина, що не є функцією стану термодинамічної системи:
а) U; б) A; в) H; г) G.
63. Фізична величина, що не є функцією стану термодинамічної системи:
а) H; б) U; в) Q; г) F.
64. Яка величина є функцією стану:
а) тепловий ефект;
б) вільна енергія Гіббса;
в) робота;
65. При якій температурі ентропія чистого кристалічного тіла дорівнює нулю:
а) 100С;
б) 2790С;
в) 00С;
г) -273,150С.
66. Процес зветься ізохорним, якщо протікає при:
а) постійному об’ємі;
б) постійному тиску;
в) постійній температурі;
г) постійному тиску та температурі.
67. Вказати математичний вираз І закону термоденаміки:
а) 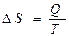 ;
;
б) ∆G=∆H-T∆S;
в) Q=∆U+A;
г) ∆F=∆U-T∆S.
68. Який математичний вираз І закону термоденаміки для ізобарних процесів:
а) -∆G=Аmax;
б) Qp=∆H;
в) Qv=∆U;
69. Величина ∆S вимірюється в:
а) Дж; б) Дж*моль; в) Дж/К; г) Дж*К.
70. Вказати термодинамічну умову ендотермічного процесу:
а) ∆H=0; б) ∆H>0; в) ∆H<0;
71. Вказати термодинамічну умову самодовільного процесу в закритій системі при ∆Т=0, ∆Р=0
а) ∆G=0; б) ∆G>0; в) ∆G<0;
72. Вказати умову термодинамічної рівноваги в
ізольованій системі:
а) ∆S=0; б) ∆S>0; в) ∆S<0;
73. Величина ∆G вимірюється в:
а) Дж; б) Дж*моль; в) Дж/К; г) Дж*К.
74. Вказати термодинамічну умову екзотермічного процесу:
а) ∆H=0; б) ∆H>0; в) ∆H<0;
75. Стандартна теплота утворення (∆H0утв) вимірюється в:
а) Дж;
б) Дж*моль;
в) Дж/К;
г) Дж*К.
76. Вказати умову термодинамічної рівноваги закритої системи при ∆V=0, ∆T=0
а) ∆F=0;
б) ∆G=0;
в) ∆F>0;
г) ∆H=0;
д) ∆F<0.
77. Калорійність харчових продуктів вимірюється:
а) Дж;
б) Дж*моль;
в) кДж/г;
г) Дж*г.
78. Як пов’язана зміна ентальпії (∆H) системи з ∆U системи:
а) ∆G=∆H-T∆S;
б) ∆H=∆U+р∆V;
в) ∆F=∆U-T∆S;
79. Яким рівнянням описується зміна вільної енергії Гіббса:
а) ∆F=∆U-T∆S;
б) ∆G=∆H-T∆S;
в) ∆H=∆U+р∆V;
г) Q=∆U+A.
80. Вказати ендергонічний процес в організмі людини:
а) гідроліз білків;
б) гідроліз полісахаридів;
в) синтез білків;
г) окиснення вуглеводів.
81. Вказати катаболічний процес в організмі людини:
а) гідроліз білків;
б) синтез нуклеїнових кислот;
в) синтез білків;
г) синтез полісахаридів.
82. Вказати анаболічний процес в організмі людини:
а) гідроліз полісахаридів;
б) окиснення глюкози;
в) синтез полісахаридів;
г) окиснення карбонових кислот.
83. Яка із систем стає гетерогенною внаслідок реакції, що відбувається в розчині:
а) AgNO3+HBr;
б) HCl+K2O;
в) NaOH+H2SO4;
84. Яка із систем залишається гомогенною після взаємодії в розчині:
а) NaCl(р)↓+AgNO3(р)→;
б) BaI2(р)↓+K2SO4(р)→;
в) H2SO4(р)↓+KOH(р)→;
85. Яка із систем залишається гомогенною в результаті взаємодії:
а) H2SO4(р)+KOH(р)→;
б) KCl(p)+AgNO3(р)→;
в) FeO(т)+H3PO4(р);
86. Чи можливий самодовільний процес, при ∆H>0 та T∆S<0:
а) можливий при ﺍ∆Hﺍ>ﺍT∆Sﺍ;
б) можливий при ﺍ∆Hﺍ<ﺍT∆Sﺍ;
в) можливий за будь-яких умов;
87. Чи можливий самодовільний процес, якщо ∆H>0, T∆S<0:
а) можливий;
б) неможливий;
в) рівноважний;
88. Чи можливий самодовільний процес, якщо ∆U>0, T∆S<0:
а) можливий;
б) неможливий;
в) процес рівноважний;
89. Якщо ∆H>0 та T∆S<0, то процес:
а) самодовільний;
б) несамодовільний;
в) рівноважний;
90. Якщо ∆H>0, а T∆S<0, то термодинамічний процес:
а) самодовільний;
б) несамодовільний;
в) рівноважний;
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 4292; Нарушение авторских прав?; Мы поможем в написании вашей работы!