
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водородные связи
|
|
|
|
Водородные связи можно моделировать, используя упрощённую электростатическую модель точечных зарядов молекулы воды.
Водородная связь воды, показанная на рис. 3a, обуславливается притяжением положительного полюса одной молекулы к отрицательному полюсу соседней молекулы воды. Во льду и в гидрате только один водород (или протон) находится между двумя атомами кислорода с расстоянием между ядрами кислорода порядка 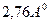 . Средний
. Средний 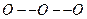 угол во льду и в гидратах отклоняется только на несколько градусов от угла в тетраэдре (109.50).
угол во льду и в гидратах отклоняется только на несколько градусов от угла в тетраэдре (109.50).
Посредством этих водородных связей каждая молекула воды присоединена к четырём другим, отдавая две и принимая две водородные связи, как иллюстрирует рис. 3b. Каждый протон молекулы присоединяется к отрицательному полюсу соседней молекулы. Также, два отрицательных полюса первой молекулы присоединяются к положительным полюсам двух других молекул воды. Четыре соседних молекулы выстраиваются в виде тетраэдра вокруг центральной молекулы.
Энергия, необходимая для того, чтобы разорвать водородную связь (около 5 ккал/моль) более чем на порядок величины больше типичной Ван дер Ваальсовой связи (около 0.3 ккал/моль), как, например, связи, которая обеспечила бы притяжение двух неполярных молекул во флюиде. С другой стороны, энергия водородной связи не настолько велика как ковалентная химическая связь (102 ккал/моль), как, например, связь, которая существует между водородом и кислородом в молекуле воды.
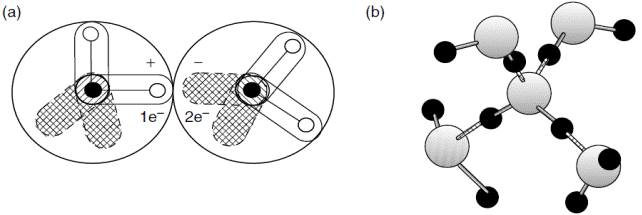
Рис. 3. Водородное связывание (водородные связи заштрихованы) (a) между двумя молекулами, и (b) между четырьмя молекулами.
|
|
|
|
|
Дата добавления: 2014-12-17; Просмотров: 476; Нарушение авторских прав?; Мы поможем в написании вашей работы!