
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фазовые диаграммы систем вода – углеводороды
Прежде чем начать говорить о фазовых диаграммах систем вода – углеводороды, поговорим о том, что представляют собой фазовые диаграммы вообще.
Термодинамические диаграммы, в которых по осям координат откладываются давление, температура, мольный объём и наносятся кривые фазового равновесия называются фазовыми диаграммами. Для многокомпонентных систем по осям координат может откладываться и состав.
Кривой фазового равновесия называется линия на фазовой диаграмме, соответствующая состояниям равновесия сосуществующих фаз.
Что такое равновесие?
Всякое физическое тело (система), поставленное в определённые внешние условия, рано или поздно приходит в состояние термодинамического (статистического) равновесия.
Это утверждение можно рассматривать как один из основных постулатов термодинамики и статистической физики.
Внешние условия характеризуются своими параметрами.
Наше тело (система) – внутренними параметрами. Эти параметры характеризуют свойства самой системы.
Внутренние параметры зависят от внешних параметров.
В состоянии термодинамического равновесия системы внутренние параметры имеют при заданных внешних параметрах и температуре (энергии) определённые численные значения.
Для равновесной системы справедливо правило фаз Гиббса. которое записывается в следующем виде:
F = K – Ф + 2,
где К – число компонентов в системе, Ф – число фаз.
Кстати, для системы в пористых средах:
F = K – Ф + 3,
то есть система имеет на одну степень свободы больше по сравнению со свободным объёмом. Возможно формирование дополнительной фазы в пористой среде.
Фазовое поведение смесей углеводород + вода значительно отличается от фазового поведения смесей нормальных углеводородов (об их фазовом поведении мы будем говорить в курсе теории фазовых переходов …). Различия возникают от двух эффектов, каждый из которых проистекает от водородных связей.
Первый, фаза гидрата покрывает значительную часть всех фазовых диаграмм углеводород + вода для углеводородов с молекулярным размером меньшим 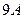 .
.
Второй, молекулы воды и углеводородов настолько различны, что в конденсированном состоянии образуются две различные жидкие фазы, каждый компонент которой очень мало растворим в другой фазе.
|
|
Дата добавления: 2014-12-17; Просмотров: 487; Нарушение авторских прав?; Мы поможем в написании вашей работы!