
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атом водорода. Атом водорода состоит из протона и электрона
|
|
|
|
Атом водорода состоит из протона и электрона. Рассмотрим движение электрона в электростатическом поле протона (протон в атоме водорода считаем неподвижным). Потенциальная энергия электрона
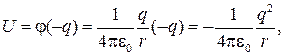
где q — заряд электрона; r — расстояние между электроном и протоном; 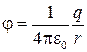 — потенциал, создаваемый протоном на расстоянии r от него.
— потенциал, создаваемый протоном на расстоянии r от него.
В случае атома водорода уравнение Шредингера следует записать в сферических координатах. Решение этого уравнения дает следующие квантовые значения механической энергии электрона в атоме
 (84.1)
(84.1)
где n = 1, 2, 3, … — квантовое число, называемое главным квантовым числом; m и q — масса и заряд электрона.
Кроме того, из решения уравнения Шредингера оказывается, что момент импульса электрона в атоме квантуется по формуле
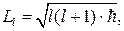 (84.2)
(84.2)
где l = 0, 1, 2, …, (n – 1) — орбитальное квантовое число. Состояние электрона, обладающего различными значениями орбитального квантового числа, в атомной физике принято обозначать и называть следующим образом:
l = 0 s -состояние
l = 1 p -состояние
l = 2 d -состояние
l = 3 f -состояние
и так далее в порядке названия букв латинского алфавита.
Рассмотрим более подробно s -состояние электрона в атоме водорода при n = 1. Такое состояние электрона и атома называют основным. Волновая функция электрона в этом состоянии является функцией только r: ψ = ψ®.
Уравнение Шредингера для основного состояния атома водорода имеет вид
 (84.3)
(84.3)
Его общее решение запишем в виде
 (84.4)
(84.4)
где C и a 0 — постоянные. Продифференцируем выражение (84.4)
 (84.5)
(84.5)
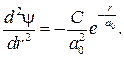 (84.6)
(84.6)
Подставляя формулы (84.4)–(84.6) в уравнение (84.3), получаем
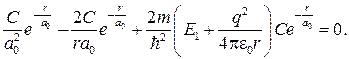

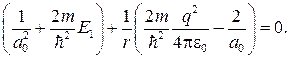
Так как последнее соотношение должно быть справедливо для любых r, то оба слагаемых в скобках в отдельности должны равняться нулю. Можем написать

откуда
 (84.7)
(84.7)
Можем написать
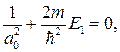
откуда с учетом формулы (84.7) получаем
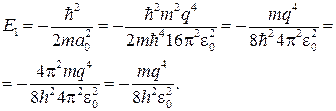 (84.8)
(84.8)
Сравнение выражение (84.1) и (84.8) показывает, что мы получили значение энергии основного состояния атома водорода, соответствующее n = 1.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 779; Нарушение авторских прав?; Мы поможем в написании вашей работы!