
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение атома. Радиоактивное превращение ядер
|
|
|
|
Радиоактивное превращение ядер
Атом является основным структурным элементом всех веществ. Атом – наименьшая частица химического элемента, являющаяся носителем его химических свойств. Химические свойства элемента определяются строением его атома.
Химический элемент – это определенный вид атомов с одинаковым положительным зарядом ядра. В настоящее время известно 108 элементов. Из них 90 существуют в природе, а около 70 содержатся в организме человека. Для обозначения химических элементов введены химические знаки или химические символы. Их обозначают начальной или начальной и одной из последующих букв латинского названия данного элемента (кислород, Oxigenium – О; натрий, Natrium – Na; цинк, Zincum –Zn и т.д.). Каждый элемент занимает в периодической таблице Д.И. Менделеева (ПСМ) определенное место, т.е. имеет порядковый номер.
Определенные атомы объединяются один с одним и образуют новые частицы – молекулы. Молекула – это наименьшая частица вещества, которая сохраняет его состав и химические свойства. В зависимости от того, состоят ли молекулы из атомов одного и того же элемента или же из атомов различных элементов, все вещества делятся на простые и сложные.
Молекулы простых веществ состоят из одного атома (Не – гелий, Ne – неон, Кr – криптон), двух (О2 – кислород, N2 – азот, Сl2 – хлор) и более атомов (S8 – сера). Один и тот же элемент может образовывать несколько простых веществ (так алмаз и графит отличаются только размещением одних и тех же атомов углерода в молекуле). Возможно и различное число атомов одного и того же элемента в молекуле (О2 – кислород, О3 – озон). Вещества, молекулы которых состояли из атомов двух и более элементов, образуют сложные вещества (Н2О, СО2, H2SO4, CH3CH2OH). Каждому элементу соответствует определенный род атома. Размеры атома чрезвычайно малые. Его диаметр составляет 10–8 см, на отрезке в 1 см можно уложить 100 млн. атомов. Масса самого простого и легкого атома – водорода ( ) составляет 1,67∙10–27кг. Атом урана (
) составляет 1,67∙10–27кг. Атом урана (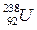 ), самый тяжелый из существующих на Земле элементов, занимающий в таблице Д.И. Менделеева 92 место, тяжелее атома водорода в 238 раз. Известны сверхтяжелые элементы, получаемые искусственным путем. Так атом плутония (
), самый тяжелый из существующих на Земле элементов, занимающий в таблице Д.И. Менделеева 92 место, тяжелее атома водорода в 238 раз. Известны сверхтяжелые элементы, получаемые искусственным путем. Так атом плутония ( ) в244раза тяжелее атома водорода.
) в244раза тяжелее атома водорода.
Все атомы химических элементов имеют одинаковую структуру. Они состоят из положительно заряженного ядра, где сконцентрирована практически вся масса атома (99,95%) и отрицательно заряженных электронов, образующих электронные оболочки вокруг ядра. В целом атом электрически нейтрален.
Модель строения атома предложил еще в 1911 г. английский физик Эрнст Резерфорд (это так называемая планетарная или ядерная модель). Атом, по Резерфорду, это своеобразная модель Солнечной системы – в центре находится тяжелое положительно заряженное ядро, вокруг которого, подобно планетам вокруг Солнца, вращаются отрицательно заряженные электроны. Датский ученый Нильс Бор усовершенствовал планетарную модель атома. Он высказал суждение, что электроны движутся не по любым орбитам, а по определенным. При этом, согласно Бору, электронные орбиты могут быть сгруппированы в отдельные электронные оболочки.
По современным данным, электрон в атоме не имеет траектории. Различные положения его рассматриваются как электронное облако с определенной плотностью отрицательного заряда. Максимальная плотность отвечает наибольшей вероятности нахождения электрона в данной части атомного пространства. Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью (вместо существовавшего ранее термина орбита).
Орбитали атома имеют разные размеры. Электроны, которые движутся в орбиталях близкого размера, образуют электронные слои. Электронные слои называют также энергетическими уровнями. Энергетические уровни нумеруют, начиная от ядра цифрами 1, 2, 3, 4, 5, 6, 7 или обозначают буквами К, L, M, N, О, Р, Q. Наибольшее число электронов на энергетическом уровне равно удвоенному квадрату номера уровня – N = 2n2. Целое число n, обозначающее номер уровня, называется главным квантовым числом. В соответствии с этим уравнением на 1–м, ближайшим к ядру энергетическом уровне, может находиться не более 2–х электронов, на 2–м уровне – не более 8, на 3–м уровне – не более 18, на 4–м уровне – не более 32 электронов и т.д.
Энергетические уровни подразделяются на подуровни, число подуровней равно значению главного квантового числа, но не превышает 4–х подуровней. Подуровни обозначают латинскими буквами s, p, d, f.
Между ядром и электронами существуют силы притяжения. Наиболее прочная связь электронов с ядром наблюдается у электронов на К–уровне, так энергия связи электронов углерода составляет 280 эВ, стронция – 16 кэВ, цезия – 36 кэВ, урана – 280 кэВ. Чем на более удаленном от ядра энергетическом уровне находится электрон, тем меньше энергия связи его с ядром. На внешних энергетических уровнях энергия связи электронов не превышает 1–2 эВ. Поэтому электроны внешних энергетических уровней более подвержены воздействию излучений низкой энергии.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 510; Нарушение авторских прав?; Мы поможем в написании вашей работы!