
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Корпускулярно-волновой дуализм микромира
|
|
|
|
Современная теория строения атома базируется на законах, описывающих движение микрочастиц, которые качественно отличаются от свойств и закономерностей движения макроскопических тел, хорошо изученных классической физикой. Движение и взаимодействие микрочастиц описывает квантовая (волновая) механика, которая основывается на принципах квантования энергии, волновом характере движения микрочастиц и вероятностном (статистическом) методе описания микрообъектов.
Формирование квантово-механических взглядов опиралось на целый ряд экспериментальных фактов, открытых к началу XX в. (фотоэффект, атомные спектры, эффект Комптона и др.)- Классические представления не могли дать приемлемого их объяснения.
Стр. 41
Гипотезу о квантовании энергии теплового излучения впервые высказал М. Планк (1900) и позднее обосновал А. Эйнштейн (1905). Энергия кванта Е зависит от частоты излучения:
E = hv, где h - универсальная постоянная (постоянная Планка), h = 6,63 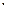 1034 Дж
1034 Дж 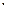 с;
с;
v - частота излучения.
А. Эйнштейн первым понял, что дискретность поглощения и испускания - неотъемлемое свойство самого излучения. Через некоторое время после введения понятия кванта он применил идею дискретности излучения к объяснению явления фотоэффекта (появление электрического тока в вакууме вследствие выбивания электронов из металла под действием излучения).
Таким образом, в теории электромагнитного излучения появились два представления. С одной стороны, электромагнитное излучение для всех длин волн обнаруживает волновые свойства (дифракция, интерференция, поляризация), что убедительно доказывает его волновую природу. С другой стороны, оно рассматривается как поток микрочастиц - фотонов (квантов энергии), корпускулярные свойства которого наглядно проявляются при фотоэффекте и комптоновском рассеянии.
На вопрос, какой из двух точек зрения отдать предпочтение, следует ответить: и та и другая сторона явления составляют сущность излучения. Таким образом, излучение имеет как волновую, так и корпускулярную природу. Этот корпускулярно-волновой дуализм является объективной реальностью существования излучения.
В 1924 г. Луи де Бройль выдвинул гипотезу о том, что двойственность свойств присуща не только электромагнитному излучению (полю), но и другой форме материи - веществу. При этом каждой частице массой т, движущейся со скоростью v, соответствует длина волны 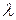 :
:
 h/mv.
h/mv.
Гипотеза де Бройля была подтверждена явлением дифракции электронов на кристаллах никеля. В настоящее время дифракция электронов, протонов, нейтронов широко используется в науке и технике для исследования структуры вещества. После экспериментального подтверждения гипотезы де Бройля было установлено, что корпускулярно-волновой дуализм присущ всей материи, т. е. как излучению (полю), так и веществу.
Стр. 42
В классической механике частица обладает свойством двигаться по вполне определенной траектории, и в любой момент времени мы можем точно определить ее координаты и скорость.
Волна таким свойством не обладает. Она не имеет координат, и нет смысла говорить о длине волны в данной точке пространства.
Из корпускулярно - волнового дуализма вытекает совершенно неожиданное правило: если мы точно знаем координаты частицы, то мы не знаем ее скорости (импульса), и наоборот, если частица имеет точно определенную скорость (импульс), мы ничего не можем сказать о ее координате. Это правило называется принципом неопределенности, установленным Г. Гейзенбергом в 1927 г., и математически записывается как

где  - неопределенность координаты x,
- неопределенность координаты x,
 - неопределенность импульса вдоль оси х;
- неопределенность импульса вдоль оси х;
h - постоянная Планка.
В квантовой физике, физике микромира, мы никогда не знаем состояние микрочастицы, системы с точностью большей, чем это допускает принцип неопределенности. Поэтому ученые вынуждены перейти на вероятностный метод описания систем и явлений микромира.
Так, понятие «материальная точка» исчезает, уступив место чему-то вроде «вероятностного облака», более или менее плотного в той или иной области пространства. Это зависит от «степени вероятности», с которой точка находится в этой области.
Прорыв в решении задачи о поведении электрона в атоме произошел с созданием Э. Шредингером (1926) волновой квантовой механики. В качестве отправных были взяты следующие положения: движение электрона имеет волновую природу; наши знания носят вероятностный характер.
Стр. 43
Поскольку имеется волновое движение, то для его математического описания должно существовать волновое уравнение. Так как для световых и звуковых волн уравнения движения известны, то можно найти такое уравнение и для электронных волн (волн де Бройля).
Э. Шредингер ввел некоторую функцию координат и времени, названную волновой функцией (пси-функцией), несущей при определенных условиях вероятностный смысл (квадрат ее модуля определял плотность вероятности нахождения электрона в данной точке пространства). Используя закон сохранения энергии для движущейся частицы, он записал волновое уравнение, решение которого определяло вид волновой функции.
По своему значению в квантовой механике уравнение Шредингера играет такую же роль, как второй закон Ньютона в классической механике. Подобно тому как в классической механике с помощью второго закона Ньютона решаются задачи, связанные с движением макроскопических тел, в квантовой механике с помощью уравнения Шредингера решаются задачи, связанные с движением микрообъектов.
Решения волнового уравнения показывают, что энергия микрочастиц может принимать строго определенные (дискретные) значения, позволяют для различных условий получить распределение плотности вероятности нахождения микрочастицы в пространстве (для электронов это орбитали, электронные облака).
Согласно решению волнового уравнения, электрон в атоме может находиться только в определенных квантовых состояниях, соответствующих разрешенным значениям его энергии связи с ядром. Для атома водорода энергия электрона может принимать только те значения, которые задаются выражением
En = -13,6  эВ,
эВ,
где п - главное квантовое число (и = 1,2,3,4,..., 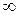 );
);
1эВ= 1,6 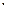 10-19 Дж.
10-19 Дж.
Графически энергию квантовых состояний и квантовых переходов можно изобразить с помощью схемы уровней энергии (рис. 7).
Квантовое состояние с наименьшей энергией (n = 1, Е1) называют основным. Остальные квантовые состояния с более высокими значениями энергии (E2, Е3, Е3,...) называют возбужденными.
Стр. 44
Электрон в основном состоянии связан с ядром наиболее прочно. С увеличением энергии эта связь ослабевает вплоть до отрыва при n  . В основном состоянии электрон в атоме может существовать неограниченно долго, а в возбужденном состоянии - ничтожно мало (для атома водорода - 10-8с).
. В основном состоянии электрон в атоме может существовать неограниченно долго, а в возбужденном состоянии - ничтожно мало (для атома водорода - 10-8с).
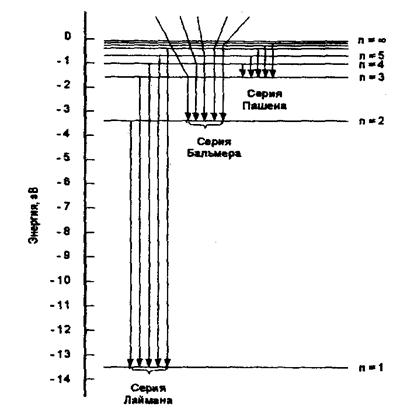
Рис. 7. Схема уровней энергии и квантовые переходы электрона в атоме водорода
Возбуждение электронов в атоме возможно различными способами (нагревание, электрический разряд, поглощение света или другого излучения). Возбуждаясь, электрон переходит на тот или иной энергетический уровень. Через 10-8с электрон перейдет на нижележащий энергетический уровень, освобождая при этом порцию энергии. Если происходит переход с уровня n = 3 на уровень п = 2, то освобождается энергия hv = Е3 – Е2 = 1,89 эВ.
Отметим, что квантовые переходы электрона соответствуют скачкообразному изменению среднего размера электронного облака: ослабление энергии связи электрона с ядром - увеличению объема облака, возрастание энергии связи - сжатию и уплотнению облака.
Экспериментально квантование энергии электронов в атомах обнаруживается в их спектрах поглощения и испускания. Атомные спектры имеют линейчатый характер.
Стр. 45
Спектры испускания легко иллюстрируются схемой уровней энергии на рис. 7. Если каким-либо способом атомарный водород перевести в возбужденное состояние, то квантовые переходы электронов с вышележащих уровней на нижележащие станут сопровождаться выделением квантов света в виде фотонов с энергией Е = hv (т. е. определенной частоты и длины волны), что будет фиксироваться появлением определенных спектральных линий. Переходам на уровень с и = 1 соответствуют линии в ультрафиолетовом диапазоне спектра (серия Лаймана), переходам на уровень с n = 2 -линии видимой области спектра (серия Бальмера) и т. д.
Очень важно, что спектры атомов строго характеристичны, т. е. индивидуальны для атомов каждого элемента. Именно это позволяет при помощи спектрального анализа определять состав вещества, в том числе и таких удаленных предметов, как Солнце и звезды.
Установлено, что электронная плотность в атоме распределена неравномерно. Область пространства, где пребывание электрона наиболее вероятно, называется орбиталью. Орбиталь однозначно можно описать с помощью набора целых чисел, называемых квантовыми числами. Как показывают расчеты, таких чисел четыре – п, l, ml, s. Известное уже нам n - главное квантовое число - определяет энергию электронного облака. Орбитальное квантовое число l определяет форму орбитали (сфера, гантелька, розетка и т. д.). Ориентацию в пространстве определяет ml - магнитное квантовое число. Четвертым квантовым числом является s - спиновое квантовое число, характеризующее собственный момент импульса частицы.
Квантовые числа характеризуют энергию электрона, объем и форму его орбитали, ее ориентацию в пространстве. При переходе атома из одного квантового состояния в другое значения квантовых чисел изменяются и происходит перестройка электронного облака.
При рассмотрении более сложных атомов (многоэлектронные системы) большое значение имеет принцип Паули, по которому в любой кванто-во-механической системе не может быть двух электронов с одинаковой четверкой квантовых чисел.
Поразительным является то, что все выводы, следующие из квантово-механических принципов, находятся в полном соответствии с построением периодической таблицы элементов Менделеева, созданной еще в 1869 г.
Стр. 46
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1278; Нарушение авторских прав?; Мы поможем в написании вашей работы!