
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Полярність зв’язків і полярність молекул в цілому. 1 страница
|
|
|
|
Тема 6. Хімічний зв’язок
Тема 5. Періодичний закон і періодична система елементів Д.І.Менделєєва
Систематизація і класифікація факторів як необхідний стан розвитку науки. Перші спроби класифікації хімічних елементів, еволюція систем хімічних елементів.
Науково-педагогічна діяльність Д.І. Менделєєва. Відкриття періодичного закону Д. І. Менделєєва. Принцип побудови природної системи елементів. Використання Д. І. Менделєєвим методу інтерполяції для виправлення атомних мас і передбачення властивостей ще невідкритих елементів. Експериментальні підтвердження теоретичних передбачень Д. І. Менделєєва.
Періодичний закон і періодична система з позиції уявлень про будову атома. Зв’язок положення атома в періодичній системі з електронною будовою його атома. Особливості електронних конфігурацій атомів елементів головних і побічних підгруп. Елементи s-, p-, d- i f-родин. Зв’язок між властивостями елементів і положенням їх в періодичній системі.
Зміна величин радіусів, енергій іонізації, спорідненості до електронегативності атомів елементів із зростанням зарядів їх ядер. Періодичність зміни властивостей елементів як прояв періодичності зміни електронних конфігурацій атомів.
Значення відкриття періодичного закону в розвитку науки. Відкриття в періодичній системі загального природного зв’язку між хімічними елементами. Еволюція і межі періодичної системи.
Короткий нарис еволюції поглядів на сутність хімічного зв’язку. Основні характеристики хімічного зв’язку. Основні типи хімічного зв’язку. Методи визначення структури речовин.
Ковалентний зв’язок. Квантово-механічні методи його трактування.
Метод валентних зв’язків (МВЗ). Два механізми утворення ковалентного зв’язку: узагальнення неспарених електронів, донорно-акцепторний механізм.
Властивості ковалентного зв’язку: насиченість, напрямленість, поляризуємість. Насиченість ковалентного зв’язку. Ковалентності атомів елементів І, ІІ і ІІІ періодів. Направленість ковалентного зв’язку.
Гібридизація АО. Умови стійкості АО. Типи гібридизації і геометрія молекул. Характеристика s– і p– зв’язків.
Кратність (порядок) зв’язку. Фактори, що впливають на міцність зв’язку.
Поляризуємість ковалентного зв’язку. Залежність поляризуємості від його довжини.
Метод молекулярних орбіталей (ММО). Фізична ідея методу. Метод ЛКАО МО. s– і p– МО як лінійні комбінації s- і p- АО; зв’язуючі і розпушуючі МО. Принципи заповнення МО. Енергетичні діаграми і електронні формули молекул.
Гомонуклеарні молекули, утворені елементами 1 і 2 періодів. Залежність кратності, міцності і довжини зв’язку, а також магнітних властивостей від характеру заповнення МО в цих молекулах. Пояснення парамагнетизму кисню.
Аналіз енергетичних діаграм гомонуклеарних молекул (N2, O2, F2 та інших). Залежність кратності, міцності і довжини зв’язку, а також магнітних властивостей від характеру заповнення МО в цих молекулах.
Гетеронуклеарні двохатомні молекули, утворені елементами 2-го періоду.
Аналіз енергетичних діаграм утворення молекул карбон (ІІ) оксиду та нітроген (IV) оксиду.
Порівняння методів ВЗ і МО.
Типи кристалічних ґраток (приклади речовин з різними типами кристалічних решіток). Властивості цих речовин.
Іонний зв’язок. Катіони і аніони в молекулах і твердих тілах. Властивості іонного зв’язку. Область застосування іонної моделі. Іонні кристалічні ґратки. Поляризація і поляризуюча дія іонів, їх вплив на властивості речовин. Властивості речовини з іонним типом зв’язку. Валентності, ступені окиснення і координаційні числа атомів в сполуках з різним типом зв’язку.
Водневий зв’язок. Міжмолекулярний та внутрішньомолекулярний водневий зв’язок. Вплив водневого зв’язку на властивості речовин. Роль водневого зв’язку в біологічних процесах.
Металічний зв’язок. Особливості електронної будова атомів елементів, здатних утворювати металічний зв’язок.
Міжмолекулярна взаємодія: диполь-диполь, диполь-індукований диполь, дисперсна взаємодія.
Тести дo модуля 1. “Будова речовини”
1.1. Встановіть відповідність між визначенням та поняттям:
| Визначення | Поняття |
| 1) найменша частинка речовини, яка має сталий склад, зберігає її хімічні властивості і здатна до самостійного існування; 2) вид атомів з однаковим зарядом ядра; 3) найменша хімічно неподільна частинка хімічного елемента, яка складається з позитивно зарядженого ядра і негативно заряджених електронів; 4) порція речовини, що містить 6 ∙ 1023 атомів або молекул; 5) різновиди атомів одного елемента, що мають однаковий заряд ядра, але різне масове число. | A)молекула; B)атом; C)хімічний елемент; D)речовина; E)ізотопи F)моль. |
1.2. Відносна атомна маса хімічного елементу є відношення маси атома елементу:
A) до маси атома Гідрогену;
B) до маси ізотопу Гідрогену 1Н;
C) до маси ізотопу Карбону 12С;
D) до 1/12 маси ізотопу Карбону 12С;
E) до маси ізотопу Оксигену 16O;
F) до 1/16 маси ізотопу Оксигену 16O.
1.3. Моль – це...
A) кількість частинок, які містяться в 1 г будь-якої речовини;
B) 1/12 маси атома Карбону-12;
C) одиниця, якою в хімії користуються при визначенні кількості речовини;
D) число молекул, які містяться в 22,4 л газу при нормальних умовах;
E) число частинок, які містяться в 1 кг будь-якої речовини.
1.4. Виберіть визначення числа Авогадро та яке його значення:
A) 6,02∙1023 моль-1. Число структурних одиниць, що містяться в 1 моль речовини;
B) 6,02∙1022 моль-1.Число структурних одиниць, що містяться в 1 г речовини;
C) 6,02∙1020 моль-1.Число структурних одиниць, що містяться в 1 г речовини;
D) 6,02∙1019 моль-1.Число структурних одиниць, що містяться в 1 кг речовини;
E) 6,02∙1021 моль-1.Число структурних одиниць, що містяться в 1 г аніонів речовини.
1.5. Виберіть визначення молярної маси:
A) відношення маси молекули даної речовини до ½ маси атома ізотопу 12С;
B) число структурних одиниць в одному молі речовини;
C) ½ частина маси атома ізотопу 12С;
D) маса речовини, взятої в кількості один моль;
E) відношення маси атомів елемента до маси речовини.
1.6. Визначте число атомів, яке містить 4 моль кальцій карбонату:
A) 6,02∙1023;
B) 24,08∙1023;
C) 30,01∙1023;
D) 96,32∙1023;
E) 120,40∙1023.
1.7. Молярний об’єм газу це:
A) об’єм 6,02·1023 молекул газу за н.у.;
B) об’єм 9 г Н2О у вигляді пари;
C) об’єм 3,01·1023 молекул газу;
D) об’єм 22 г СО2;
E) об’єм в 22,4 л газу при нормальних умовах.
1.8. Встановіть послідовність величин для амоніаку згідно з ланцюжком об'єм (н. у., л) → маса (г) → кількість речовини (моль) → кількість молекул → кількість атомів:
A) 4,816 ∙ 1023;
B) 0,20;
C) 1,204 ∙ 1023;
D) 3,40;
E) 4,48.
1.9. Виберіть усі твердження, в яких йдеться про хімічний елемент:
A) у рослинні організми фосфор потрапляє з мінеральних добрив;
B) магній міститься у морській воді;
C) залізо при нагріванні із сіркою утворює сульфід;
D) природний хлор складається з двох нуклідів;
E) сплави алюмінію використовують у літакобудуванні.
1.10. Вкажіть алотропну модифікацію Оксигену:
A) озон;
B) графіт;
C) кварц;
D) корунд;
E) алмаз.
1.11. Виберіть назву закону відповідно його формулюванню: «Маса речовин, що вступили в реакцію, дорівнює масі речовин, що утворилися внаслідок реакції»:
A) закон простих об’ємних відношень;
B) закон Авогадро;
C) закон збереження маси;
D) закон кратних відношень;
E) закон сталості складу.
1.12. Виберіть назву закону відповідно його формулюванню: «Сумарні маса та енергія речовин, які вступили в реакцію, завжди дорівнюють сумарним масі та енергії продуктів реакції»:
A) закон Авогадро;
B) закон простих об’ємних відношень;
C) закон збереження маси;
D) закон збереження маси й енергії;
E) закон кратних відношень.
1.13. Виберіть назву закону відповідно його формулюванню: «Якщо два елементи утворюють один з одним кілька сполук молекулярної будови, то на одну й ту саму кількість одного елемента припадають такі кількості іншого, які відносяться між собою як невеликі цілі числа»:
A) закон збереження маси;
B) закон сталості складу;
C) закон Авогадро;
D) закон простих об’ємних відношень;
E) закон кратних відношень.
1.14. Виберіть назву закону відповідно його формулюванню: «За однакових умов об’єми газів, що вступають в реакцію, відносяться один до одного, а також до об’ємів газоподібних продуктів реакції як невеликі цілі числа»:
A) закон простих об’ємних відношень;
B) закон збереження маси;
C) закон сталості складу;
D) закон Авогадро;
E) закон кратних відношень.
1.15. Виберіть назву закону відповідно його формулюванню: «В однакових об’ємах різних газів за однакових умов (температури та тиску) міститься однакова кількість молекул»:
A) закон сталості складу;
B) закон простих об’ємних відношень;
C) закон збереження маси;
D) закон кратних відношень;
E) закон Авогадро.
1.16. Молярна маса речовини еквіваленту для кальцій гідроксиду (М(Са(ОН)2) =
74 г/моль) дорівнює:
A) 19 г/моль;
B) 37 г/моль;
C) 32 г/моль;
D) 74 г/моль;
E) 148 г/моль.
1.17. Вкажіть речовину, яка має однакові значення молярної і еквівалентної мас:
A) HCl;
B) Na2SO4;
C) H3PO4;
D) Al2(SO4)3;
E) Mg(OH)2.
1.18. Установіть відповідність між молярною масою речовини еквіваленту ортофосфатної кислоти і рівнянням хімічної реакції, в якій бере участь ця кислота:
| МЕ, г/моль | Реакція |
| 1)М (H3PO4)/2 | A)H3PO4 + NaOH = NaH2PO4 + H2O |
| 2)М (H3PO4)/3 | B)H3PO4 + 2NaOH = Na2HPO4 + 2H2O |
| 3)М (H3PO4) | C)H3PO4 + 3NaOH = Na3PO4 + 3H2O |
1.19. Виберіть твердження щодо розрахунку відносної густини газу за воднем:
A) відношення молекулярної маси водню до молекулярної маси даного газу;
B) відношення абсолютної густини водню до абсолютної густини даного газу;
C) відношення молярної маси даного газу до молярної маси водню;
D) добуток молярної маси даного газу та молярної маси водню;
E) відношення маси даного газу до молярної маси водню.
1.20. Яка молекулярна маса невідомого газу, якщо його густина за воднем дорівнює 20:
A) 10 г/моль;
B) 40 г/моль;
C) 20 г/моль;
D) 30 г/моль;
E) 50 г/моль.
1.21. Виберіть твердження щодо масових часток елементів у малахіті (СuOН)2СO3:
A) оксигену найменша;
B) оксигену найбільша;
C) гідрогену найменша;
D) купруму найменша;
E) карбону найбільша.
1.22. Виберіть твердження щодо газу, що має формулу Н2Х і густину за воднем 17:
A) 1 л цього газу за нормальних умов має масу 17 г;
B) цей газ легший за повітря;
C) молярна маса цього газу — 17 г/моль;
D) порядковий номер елемента X — 16;
E) об’єм 2 моль газу за н.у. дорівнює 22,4 л.
1.23. Виберіть твердження щодо сполуки ХО, яка при спалюванні перетворюється на газ ХO2 з густиною за воднем 22:
A) молярна маса ХO2 дорівнює 28 г/моль;
B) молярна маса ХО дорівнює 44 г/моль;
C) співвідношення об'ємів ХО та кисню в реакції горіння дорівнює 2:1;
D) X — елемент із порядковим номером 5;
E) цей газ легший за повітря.
1.24. Виберіть суміші газів, для яких будуть чисельно збігатися масові та об'ємні частки:
A) N2 і С2Н6;
B) O2 і N2;
C) СO2 і N2O;
D) СО і С2Н4;
E) СО і N2.
1.25. Встановіть відповідність між хімічною формулою та валентністю Хлору:
| Хімічна формула: | Валентність Хлору: |
| 1. NaClO; 2. NaClO2; 3. NaClO3; 4. NaClO4. | A)VI; B)V; C)ІІІ; D)І; E)VII. |
1.26. Який об’єм водню виділиться при взаємодії 2 моль цинку із сульфатною кислотою за реакцією: Zn + H2SO4 = ZnSO4 + H2↑
A) 22,4л;
B) 11,2л;
C) 48,0 л;
D) 44,8л;
E) 33,6 л.
1.27. Виберіть усі твердження щодо реакції розчинення 5,60 г заліза в розчині хлоридної кислоти, який містить 10,96 г кислоти:
A) виділяється водень, кількістю речовини 0,1 моль;
B) утворюється сіль FeCl3, кількістю речовини 0,1 моль;
C) утворюється сіль FeCl2, кількістю речовини 0,1 моль;
D) залишається хлоридна кислота, кількістю речовини 0,1 моль;
E) солі утворюється удвічі більше, ніж залишається кислоти.
1.28. При випалюванні вапняку, що містить 8% домішок, було одержано 25,76 кг кальцій оксиду. Маса взятого вапняку становить:
A) 25 кг;
B) 50 кг;
C) 100 кг;
D) 150 кг;
E) 200 кг.
1.29. При пропусканні 2,8 л (н.у.) дигідрогенсульфіду через надлишок розчину купрум (ІІ) сульфату утворився осад масою 11,4 г. Вихід продукту відносно теоретичного становить:
A) 80%;
B) 85%;
C) 90%;
D) 95%;
E) 100%.
1.30. Для повного розчинення суміші заліза з цинком масою 3,07 г витратили розчин, в якому міститься гідрогенхлорид масою 3,65 г. Вміст заліза в суміші становить:
A) 35,00%;
B) 36,48%;
C) 39,15%;
D) 40,52%;
E) 42,12%.
1.31. Виберіть перелік типів оксидів, який відповідає класифікації їх за функціональними властивостями:
A) основні, кислотні і амфотерні;
B) солетворні, основні, кислотні і амфотерні;
C) несолетворні і солетворні, які в свою чергу поділяються на основні, кислотні і амфотерні;
D) несолетворні, основні, кислотні і амфотерні;
E) солетворні і несолетворні.
1.32. Встановіть відповідність класу сполуки її формулі:
| Клас сполуки: | Хімічна формула: |
| 1) кислотний оксид; 2) амфотерний оксид; 3) основний оксид; 4) пероксид; 5) несолетворний оксид. | A)CrO; B)CrO3; C)Cr2O3; D)CrO5. |
1.33. Виберіть основні речовини:
A) Fe(OH)2;
B) ZnO;
C) Na2O;
D) SO3;
E) АІ(ОН)3;
F) CO.
1.34. Виберіть кислотні сполуки:
A) Fе(ОН)3;
B) СrO3;
C) NаОН;
D) Н3РO4;
E) Zn(OН)2;
F) NO.
1.35. Виберіть амфотерні сполуки:
A) Аl2O3;
B) Сr(ОН)3;
C) КОН;
D) H3PO4;
E) ZnO;
F) N2O.
1.36. Встановіть відповідність класу сполуки її формулі:
| Клас сполуки: | Хімічна формула: |
| 1) середня сіль; 2) кисла сіль; 3) основна сіль; 4) оксосіль; 5) подвійна сіль. | A)Аl2(SO4)3; B)Сr(ОН)2Сl; C)Ва(НСO3)2; D)SbONO3; E)NaKSO4. |
1.37. Вкажіть загальне число середніх, кислих, основних солей, які можуть утворитись при взаємодії Cu(OH)2 + H2SO4:
A) 3;
B) 4;
C) 5;
D) 6;
E) 7.
1.38. Встановіть відповідність між формулою і назвою сполуки:
| 1) H2SiO3; 2) Fe (OH)3; 3) Cr2 (SO4)3; 4) NaH2PO4; 5) (CuOH)2CO3. | A)хром (ІІІ) сульфат; B)натрій дигідрогенортофосфат; C)силікатна кислота; D)ферум (III) гідроксид; E)дигідрогенортофосфат натрію; F)дигідроксокупрум (ІІ) карбонат. |
1.39. Встановіть відповідність між формулою і назвою сполуки:
| 1) CaH2; 2) H2S; 3) HCl; 4) KAl (SO4)2; 5) Al (NO3) (SO4) | A)алюміній калій сульфат; B)хлоридна кислота; C)дигідрогенсульфід; D)алюміній сульфат нітрат; E)кальцій дигідрид; F)дигідрогенсульфіт. |
1.40. Виберіть реакції, у результаті яких можна одержати карбон (IV) оксид:
A) CO + C 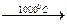 ;
;
B) CaCO3 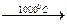 ;
;
C) C + HCl 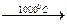 ;
;
D) C + O2 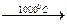 ;
;
E) CaCO3 + SiO2 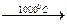 .
.
1.41. Виберіть реакції, у результаті яких можна одержати натрій гідроксид:
A) NaCl + Н2O →;
B) NaNO3 + КОН →;
C) Na2SO4 + Ва(ОН)2 →;
D) Na + Н2O→;
E) Na2O + Н2O→.
1.42. Виберіть реакції, у результаті яких можна одержати ферум(ІІ) гідроксид:
A) FeCl2 + O2 →;
B) FeCl2 + КОН →;
C) FeOHNO3 + Ва(ОН)2 →;
D) Fe + Н2O 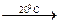 ;
;
E) FeO + Н2O 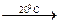 .
.
1.43. Виберіть реакції, у результаті яких можна одержати нітратну кислоту:
A) NO2 + O2 + Н2O →;
B) NaNO3 + HCl →;
C) NaNO3 + H2SO4(K) →;
D) NO + Н2O →;
E) N2 + O2 + Н2O →.
1.44. Виберіть реакції, у результаті яких можна одержати алюміній гідроксид:
A) Al (NO3)3 + KOH →;
B) AlCl3 + NaOH →;
C) Al2O3 + H2O →;
D) Na [Al (OH)4] + H2SO4 →;
E) Al + H2 →.
1.45. Виберіть реакції, у результаті яких можна одержати ферум(ІІ) хлорид:
A) FeO + Сl2 →;
B) Fe(OH)2 + HCl→;
C) ВаСl2 + FeSO4 →;
D) Fe2O3 + HCl→;
E) CuCl2 + Fe →.
1.46. Виберіть речовини, з якими взаємодіє барій оксид:
A) нітроген (V) оксид;
B) вода;
C) нітратна кислота;
D) цинк оксид;
E) кальцій оксид.
1.47. Виберіть речовини, з якими взаємодіє кальцій гідроксид за нормальних умов:
A) карбон (IV) оксид;
B) алюміній оксид;
C) нітратна кислота;
D) алюміній гідроксид;
E) натрій оксид.
1.48. Виберіть речовини, з якими взаємодіє цинк гідроксид:
A) сульфатна кислота;
B) алюміній оксид;
C) карбон (IV) оксид;
D) барій оксид;
E) натрій гідроксид.
1.49. Виберіть речовини, з якими взаємодіє сульфатна кислота:
A) алюміній гідроксид;
B) карбон (IV) оксид;
C) кальцій оксид;
D) цинк гідроксид;
E) натрій силікат.
1.50. Виберіть речовини, з якими взаємодіє купрум (ІІ) сульфат:
A) хлоридна кислота;
B) залізо;
C) барій хлорид;
D) калій гідроксид;
E) сульфідна кислота.
1.51. Виберіть речовини 1, 2, 3 і 4 для здійснення перетворень згідно зі схемою основний оксид (1) → гідроксид (2) → сіль (3) → кислотний оксид (4):
A) Na2O;
B) ZnO;
C) NaOH;
D) Na2CO3;
E) Сu(ОН)2;
F) CuSO4;
G) СO2;
H) SO3.
1.52. Виберіть речовини 1, 2, 3 і 4 для здійснення перетворень згідно зі схемою сіль (1) → бінарна сполука (2) → основа (3) → сіль (4):
A) Na2SO3;
B) SO2;
C) NH4Cl;
D) (NH4)2SO4;
E) NH3;
F) H2SO4;
G) NH4OH;
H) CuSO4.
1.53. Встановіть відповідність між номером та назвою складової комплексної сполуки:
 5
[Co (NH3)4 ] Cl3
↑ ↑ ↑ ↑
1 2 3 4 5
[Co (NH3)4 ] Cl3
↑ ↑ ↑ ↑
1 2 3 4
| A)зовнішня сфера; B)внутрішня сфера; C)комплексоутворювач; D)ліганди; E)координаційне число; F)координаційна ємність. |
1.54. Встановіть відповідність між формулою комплексної сполуки і типом, до якого вона належить:
| 1) K4 [Fe (CN)6]; 2) [Cu (H2O)4] SO4; 3) [Ni (CO)4]; 4) [Co (NH3)5SO4]NO3; 5) Na2 [Zn (OH)4]. | A)катіонні комплекси; B)аніонні комплекси; C)нейтральні комплекси. |
1.55. Встановіть відповідність між формулою і назвою комплексної сполуки:
| 1) Fe3[Fe (CN)6]2; 2) Na [Al (OH)4]; 3) [Pt Cl2 (NH3)2]; 4) [Cu (NH3)4] (OH)2; 5) [Cr (H2O)6] Cl3. | A)гексаквахром (III) хлорид; B)натрій тетрагідроксоалюмінат; C)тетраамінкупрум (II) гідроксид; D)натрій тетрагідроксидалюмінат; E)ферум (ІІ) гексаціаноферат (ІІІ); F)диаміндихлороплатина. |
1.56. Встановіть відповідність між видом частинки та її характеристикою:
| Частинка: | Характеристика: |
| 1)ядро; 2)протон; 3)електрон; 4)нейтрон. | A)позитивно заряджена частина атома, в якій зосереджена практично вся його маса; B)електронейтральна частинка з масою спокою 1,67·10-27 кг; C)частинка з масою спокою 9,1·10-31 кг і негативним зарядом 1,6·10-19Кл; D)частинка з масою спокою 1,67·10-27 кг і позитивним зарядом 1,6·10-19Кл; E)область простору, в якому велика ймовірність перебування електрона. |
1.57. Головне квантове число характеризує:
A) форму і симетрію орбіталі;
B) розташування орбіталі в просторі;
C) розмір електронної хмари;
D) загальну енергію електрона орбіталі;
E) максимальне число електронів в електронному шарі.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1094; Нарушение авторских прав?; Мы поможем в написании вашей работы!