
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Полярність зв’язків і полярність молекул в цілому. 2 страница
|
|
|
|
1.58. Вкажіть формули, якими визначається максимальне число електронів із заданим головним квантовим числом n і кількість орбіталей на рівні n:
A) 2 n + 1 і 2 n 2;
B) n 2 і 2 n 2;
C) 2 n 2 і n -1;
D) n -1 і n 2;
E) 2 n 2 і n.
1.59. Вкажіть значення орбітального квантового числа (l), що відповідає р -підрівню:
A) -1;
B) 0;
C) 1;
D) 2;
E) 3.
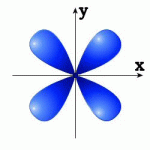
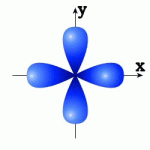
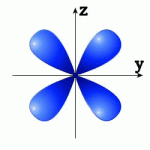
1.60. Встановіть відповідність між номером і просторовою орієнтацією орбіталей A - 3dz2, B - 3dyz, C - 3dx2 y2 , D - 3dxy:
| 
| 
| 
|
1.61. Вкажіть, якими факторами визначається розподіл електронів по орбіталях в основному стані атома:
A) принципом заборони Паулі;
B) рівнянням Больцмана;
C) правилом Хунда;
D) правилом Клечковського;
E) принципом найменшої енергії.
1.62. Вкажіть послідовність розташування рівнів в порядку збільшення енергії:
| 1. | 2. | 3. | 4. | 5. |
| 4d | 4f | 5p | 6p | 5s |
1.63. Вкажіть кількість неспарених електронів в атомах (у основному стані):
| Атом | Кількість неспарених електронів | ||
| A)A | Ar; | 0; | |
| B)B | Ba; | 1; | |
| C)C | Br; | 2; | |
| D)D | Cr; | 3; | |
| E)E | N. | 6. |
1.64. Виберіть елемент, у якого всі атомні орбіталі завершені:
A) Ar;
B) N;
C) Na;
D) Zn;
E) Сl.
1.65. Вкажіть порядковий номер хімічного елементу, для якого представлений розподіл електронів по орбіталях:
A) 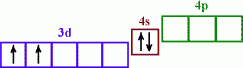 14;
14;
B) 22;
C) 32;
D) 40;
E) 18.
1.66. Вкажіть електронну конфігурацію атома в основному стані:
A) 1 s 22 s 12 p3;
B) 1 s 22 s 22 p 63 s 13 p 1;
C) 1 s 22 s 22 p 53 s 2;
D) 1 s 22 s 22 p 5;
E) 1 s 22 s 12 p 6.
1.67. Вкажіть елемент, якщо електронна формула його атома 4s23d8:
A) Ni;
B) Cu;
C) Zn;
D) Pt;
E) Mn.
1.68. Вкажіть іон елемента, який має електронну будову атома Аргона:
A) Li + ;
B) N3-;
C) Se2-;
D) К + ;
E) F-.
1.69. Вкажіть атом елемента, який має електронну будову іону Сl-:
A) Na;
B) Аr;
C) Мg;
D) Ne;
E) K.
1.70. Вкажіть електронні формули атома або іону Хлору, коли він здатен проявляти валентність I:
A) 1 s 2 2 s 2 2 p 6 3 s 1 3 p 3 3 d 3;
B) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 5;
C) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 4 3 d 1;
D) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 3 3 d 2;
E) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6.
1.71. Встановіть відповідність нукліду елемента кількості протонів та нейтронів:
| Нуклід: | Кількість протонів та нейтронів: |
| 1)23Nа; 2)39Са; 3)19F. | A)9 та 10; B)19 та 20; C)20 та 19; D)10 та 9; E)11 та 12. |
1.72. Із запропонованих електронних структур частинок побудуйте послідовність, що відповідає схемі перетворення Сl0 → Сl–→ Сl + :
A) 1 s 22 s 22 p 63 s 23 p 4;
B) 1 s 22 s 22 p 63 s 23 p 3;
C) 1 s 22 s 22 p 63 s 23 p 6;
D) 1 s 22 s 22 p 63 s 23 p 5;
E) 1 s 22 s 22 p 63 s 13 p 6.
1.73. Встановіть відповідність зміни формули валентних електронів в атомі елемента та процесу, який відбувся:
| Зміна формули валентних електронів: | Процес, який відбувся: |
| 1)3 s 23 p 3 → 3 s 23 p 0; 2)3 s 23 p 3 → 3 s 23 p 6; 3)4 s 23 d 3 → 4 s 03 d 3; 4)4 s 23 p 5 → 4 s 23 p 6. | A)Е° + 3е = Е3-; B)Е° - 3е = Е3+; C)Е° + 1е = Е-; D)Е° + 2е = Е2-; E)Е° - 2е = Е2+. |
1.74. Встановіть відповідність між валентними електронами в атомі елемента та фрагментом періодичної системи:
| Фрагмент періодичної системи: | Валентні електрони в атомі елемента: |
| 1)III період, група V A; 2)III період, група IV А; 3)IV період, група III Б; 4)IV період, група VI Б; 5)IV період, група V А. | A)3s23 p 2; B)3 d 14 4s 2; C)3s23 p 3; D) 3 d 5 4s1. |
1.75. Встановіть відповідність між типом елемента та валентними електронами в атомі:
| Тип елемента: | Валентні електрони в атомі елемента: |
| 1) d -елемент; 2)р-елемент; 3) d -елемент. | A)3s23 p 2; B)3s1 4d 2; C)5 f 76s2; D)3s2. |
1.76. Встановіть відповідність між валентними електронами в атомі елемента та формулою оксиду:
| Формула оксиду елемента: | Валентні електрони в атомі елемента: |
| 1)Е2O3; 2)Е2O5; 3)ЕО2; 4)ЕО; 5)Е2O. | A)4s23 d 3; B)4s23 d 2; C)4s2; D)4s23 d 1. |
1.77. Амфотерні оксиди утворюють:
A) d-елементи в їх проміжних ступенях окислення;
B) d-елементи в їх вищих ступенях окислення;
C) d-елементи в їх мінімальних ступенях окислення;
D) всі d-елемент;
E) s-елементи.
1.78. Встановіть відповідність елемента радіусу його атома, якщо в другому періоді радіус атома змінюється в межах 0,159 нм — 0,035 нм:
| Елемент: | Радіус, нм: |
| 1)Li; 2)Ве; 3)В; 4)С. | A)0,078; B)0,062; C)0,035; D)0,159. |
1.79. Встановіть відповідність елемента енергії іонізації його атома, якщо в ІА підгрупі енергія іонізації змінюється в межах 13,6 – 4,2 еВ:
| Елемент: | Енергія іонізації, еВ: |
| 1)Li; 2)К; 3)Rb; 4)Nа; 5)H. | A)5,1; B)13,6; C)4,2; D)4,3; E)5,4. |
1.80. Встановіть відповідність елемента величині його електронегативності, якщо в другому періоді електронегативність змінюється в межах 0,97 – 4,10:
| Елемент: | Електронегативність за Полінгом: |
| 1)Li; 2)F; 3)О; 4)B; 5)C. | A)2,01; B)3,50; C)2,50; D)0,97; E)4,10. |
1.81. Вкажіть чинник, що визначає періодичність зміни властивостей елементів:
A) заряд ядра;
B) ступінь окиснення;
C) валентність;
D) атомний радіус;
E) електронегативність.
1.82. Виберіть відповідь, яка розкриває фізичний зміст хімічної періодичності:
A) періодична зміна конфігурації валентних електронів зі збільшенням заряду ядер атомів;
B) періодична зміна атомних мас елементів зі збільшенням заряду ядер атомів;
C) періодична зміна заряду ядер атомів зі збільшенням атомних мас елементів;
D) періодична зміна електронних конфігурацій атомів зі збільшенням радіуса атомів;
E) періодична зміна конфігурації валентних електронів зі збільшенням атомних мас елементів.
1.83. Розташуйте елементи у порядку зростання металічних властивостей:
A) Сl;
B) Мg;
C) Р;
D) S;
E) Na.
1.84. Розташуйте елементи у порядку зростання неметалічних властивостей:
A) F;
B) Аt;
C) І;
D) Вг;
E) Сl.
1.85. Виберіть визначення хімічного зв'язку:
A) сили, що зв'язують ядра і електрони між собою;
B) енергетично вигідна взаємодія між атомами, молекулами, іонами в речовині;
C) сили, що діють між протонами і нейтронами в ядрі атома;
D) зміни, що відбуваються з атомом одного елемента під впливом атома іншого елемента;
E) наслідок взаємодії електронів і ядер атомів, що зумовлює існування хімічних сполук – молекул, іонів, радикалів, кристалів.
1.86. Вкажіть процес, що відбувається при утворенні ковалентного неполярного зв'язку:
A) зміщення електронної густини від одного атома до другого;
B) передача електронів від одного атома до другого;
C) усуспільнення неспарених електронів і рівномірний розподіл електронної густини між атомами;
D) передача пари електронів донором на вільну орбіталь акцептора;
E) усуспільнення неспарених електронів і зміщення електронної густини до більш електронегативного атома.
1.87. Виберіть критерії, за якими хімічний зв'язок відносять до ковалентного полярного:
A) електронегативності елементів однакові;
B) електронегативності елементів значно відрізняються;
C) зв'язок утворено між атомами одного й того ж елемента;
D) зв'язок утворено між атомами різних неметалічних елементів;
E) зв'язок утворено між атомами металічних елементів.
1.88. Виберіть характеристики донорно-акцепторного механізму утворення ковалентного зв'язку:
A) усуспільнення неспарених електронів, що належать різним атомам;
B) надання вільної орбіталі одним атомом та неподіленої пари електронів іншим;
C) електростатична взаємодія протилежно заряджених іонів;
D) усуспільнення валентних електронів, що вільно переміщуються у кристалі;
E) усуспільнення неподіленої пари електронів, що належить одному з атомів.
1.89. Виберіть частинки з ковалентним зв'язком, утвореним за донорно-акцепторним механізмом:
A) НSO4-;
B) NН4 + ;
C) Н2О;
D) СO2;
E) NH3·BF3.
1.90. Вкажіть, яка властивість ковалентного зв’язку зумовлює просторову структуру молекул:
A) направленість;
B) насичуваність;
C) полярність;
D) поляризованість;
E) енергія.
1.91. Виберіть процес вирівнювання атомних орбіталей за енергією та формою:
A) поляризація;
B) іонізація;
C) структуризація;
D) гібридизація;
E) рефракція.
1.92. Вкажіть відмінне для σ- і π-зв'язків:
A) число електронів, які утворюють зв'язок;
B) зміщення електронної пари до одного з атомів;
C) полярність зв'язку;
D) розташування області підвищеної електронної густини;
E) максимальне число зв’язків, утворених атомом.
1.93. Встановіть відповідність між молекулою та типом гібридизації орбіталей центрального атома:
| Молекула: | Тип гібридизації орбіталей центрального атома: |
| 1)CO2; 2)CCl4; 3)BCl3; 4)O2. | A)гібридизація не відбувається; B)s p 2; C)s p 3; D)s p; E)s p 2 d 3. |
1.94. Встановіть відповідність між просторовою будовою частинки та типом гібридизації орбіталей центрального атома:
| Просторова будова: | Тип гібридизації орбіталей центрального атома: |
| 1)трикутна; 2)лінійна; 3)тетраедрична; 4)октаедрична. | A)s p 2 d; B)s p 2; C)s p 3; D)s p; E)s p 2 d 2. |
1.95. Розташуйте формули сполук у порядку зменшення полярності зв'язку у молекулі:
A) Н2S;
B) Н2О;
C) Н2Sе;
D) К2O;
E) H2Te.
1.96. Виберіть неполярні молекули, що мають полярні ковалентні зв'язки:
A) ССl4;
B) CO2;
C) H2O;
D) CО;
E) SO2.
1.97. Виберіть молекули, в яких існує потрійний зв'язок:
A) N2;
B) О2;
C) F2;
D) Н2;
E) CO.
1.98. Виберіть характеристику, яка визначає міцність зв'язку:
A) заряди ядер атомів, що утворюють молекулу;
B) ступінь перекривання електронних орбіталей атомів, що утворюють молекулу;
C) здатність атомів, що утворюють молекулу, до поляризації;
D) ступінь окиснення атомів, що утворюють молекулу;
E) енергія зв’язку.
1.99. Виберіть положення, які відповідають методу молекулярних орбіталей:
A) кожний електрон в молекулі перебуває на певній молекулярній орбіталі;
B) молекулярна орбіталь одноцентрова;
C) електронна хмара належить одночасно кільком атомним ядрам;
D) стан електронів в молекулі визначається квантовими числами;
E) електрони заповнюють молекулярні орбіталі в міру підвищення їх енергетичного рівня згідно принципу Паулі і правилу Гунда.
1.100. Виберіть правильні відповіді згідно методу молекулярних орбіталей:
A) молекула О2 має будову: O2[(σ2 s)2(σ2 s)2(σ2 pz)2(π2 px)2(π2 py)2(π2 px)1(π2 py)1];
B) в молекулі О2 два неспарених електрони;
C) в молекулі О2 надлишок зв’язуючих електронів становить чотири;
D) зв'язок між атомами Оксигену потрійний;
E) кисень має діамагнітні властивості.
1.101. Виберіть правильні відповіді згідно методу молекулярних орбіталей:
A) молекула СО має будову: CO [(σ2 s)2(σ2 s)2(π2 px)2(π2 py)2(σ2 pz)2];
B) в молекулі СО на молекулярних орбіталях десять валентних електронів;
C) в молекулі СО надлишок зв’язуючих електронів становить шість;
D) зв'язок між атомами Карбону і Оксигену подвійний;
E) електронна будова молекули СО аналогічна електронній будові
молекули Вr2.
1.102.  Виберіть молекулу, утворену елементом 2 періоду, енергетична схема якої:
Виберіть молекулу, утворену елементом 2 періоду, енергетична схема якої:
А) B2;
B) C2;
C) N2;
D) O2;
E) F2.
1.103. Встановіть відповідність між збільшенням надлишку зв’язуючих електронів та міцністю хімічного зв’язку:
| Надлишок зв’язуючих електронів в молекулі: | Енергія зв’язку, кДж/моль |
| 1. Li2 – 2; 2. B2 – 2; 3. C2 – 4; 4. N2 – 6. | A)941; B) 289; C)602; D)105; E) 0. |
1.104. Виберіть тип хімічного зв'язку, що характеризується ненасичуваністю і ненапрямленістю у просторі:
A) іонний;
B) ковалентний полярний;
C) ковалентний неполярний;
D) водневий;
E) металічний.
1.105. Виберіть сполуки з іонним типом зв'язку:
A) ССl4 (рідина);
B) SiO2 (тверда речовина);
C) КСl (тверда речовина);
D) NН3 (газ);
E) NaOH (тверда речовина).
1.106. Виберіть сполуки, в яких валентність та ступінь окиснення Карбону чисельно не збігаються:
A) СН4;
B) СO2;
C) С2Н2;
D) Н2СO3;
E) СO.
1.107. Вкажіть механізм утворення водневого зв’язку:
A) донорно-акцепторна взаємодія між атомом Гідрогену, який зв’язаний з більш електронегативним елементом, та атомом іншого електронегативного елементу;
B) електростатична взаємодія протилежно заряджених іонів;
C) утворення "електронного газу";
D) донорно-акцепторна взаємодія між двома атомами з однаковою електронегативністю;
E) дисперсійна взаємодія.
1.108. Виберіть характеристики металічного зв’язку:
A) усуспільнені валентні електрони сильно делокалізовані і вільно переміщуються в кристалі;
B) багатоцентровий хімічний зв'язок з дефіцитом електронів;
C) невелике число валентних електронів одночасно зв’язує велике число атомних ядер;
D) відсутність просторової напрямленості та насичуваності зв’язку;
E) електростатична взаємодія іонів.
1.109. Вкажіть характеристики міжмолекулярної взаємодії:
A) виявляється на значно більших відстанях, ніж для хімічних сил;
B) універсальна – відбувається між усіма атомами і молекулами;
C) енергія міжмолекулярної взаємодії більша за енергію хімічного зв’язку;
D) енергія міжмолекулярної взаємодії складається з енергії орієнтаційної, індукційної та дисперсійної взаємодії;
E) відсутність насичуваності і напрямленості.
1.110. Виберіть процеси, в яких виявляється дія сил міжмолекулярної взаємодії:
A) адсорбція;
B) перехід з газуватого стану в рідкий або твердий;
C) каталіз;
D) розчинення;
E) хімічна реакція.
1.111. Встановіть відповідність між типом кристалічної гратки та речовиною:
| Тип кристалічної гратки: | Речовина: |
| 1)іонна; 2)молекулярна; 3)атомна; 4)металічна. | A)С; B)КСl; C)Мg; D)СO2; E)Не. |
ЗМІСТОВИЙ МОДУЛЬ 2.
ХІМІЧНІ ПРОЦЕСИ
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1048; Нарушение авторских прав?; Мы поможем в написании вашей работы!