
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 15. Кількісна характеристика ОВР
|
|
|
|
Тема 14. Якісна характеристика ОВР
E)H2O, H2SO4, BaCl2.
3.71. Визначте якісний склад розчину після змішування рівних мас 10% водних розчинів BaCl2 та H2SO4 і відділення осаду:
A) H2O, BaCl2;
B) H2O, H2SO4;
C) BaCl2, H2SO4, HCl, H2O;
D) H2O, H2SO4, HCl;
E) H2O, HCl.
3.72. Виберіть умову, за якою утворюється осад:
A) [Ag + ][Cl-] = ДРAgCl ;
B) [Ag + ][Cl-] > ДРAgCl ;
C) [Ag + ][Cl-] < ДРAgCl ;
D) [Ag + ] + [Cl-] = ДРAgCl ;
E) [Ag + ] + [Cl-] ≥ ДРAgCl .
3.73. Виберіть твердження, яке визначає добуток розчинності як:
A) добуток концентрацій іонів в розчині важкорозчинної речовини, поділений на концентрацію самої речовини;
B) добуток концентрацій іонів в насиченому розчині важкорозчинної речовини;
C) добуток концентрацій іонів, підведених у ступінь, що відповідна стехіометричним коефіцієнтам в рівнянні дисоціації, в насиченому розчині важкорозчинної речовини;
D) добуток концентрацій іонів Гідрогену та гідроксиду;
E) добуток рівноважних концентрацій всіх іонів, що містяться у розчині.
ЗМІСТОВИЙ МОДУЛЬ 4.
ОКИСНО - ВІДНОВНІ РЕАКЦІЇ (ОВР)
Електронна теорія окислення-відновлення (ОВР). Окисники і відновники. Правило складних рівнянь ОВР за методом електронного балансу.
Класифікація ОВР. Електронно-іонний метод складання рівнянь ОВР. Роль середовища в протіканні ОВ процесів.
Взаємодія металів з кислотами і солями в водних розчинах як ОВ процес.
Одержання електричного струму при хімічних реакціях. Механізм дії гальванічного елементу. Водневий електрод порівняння. Стандартні електродні потенціали. Рівняння Нернста. Роботи М.М. Бекетова. Електрохімічний ряд стандартних електродних потенціалів металів. Напрямленість ОВР в розчинах.
Електроліз як ОВ процес. Корозія і методи захисту від корозії. Значення ОВР в живій і неживій природі. Фотосинтез як ОВ процес. ОВ процеси в виробництві.
Тести дo модуля 4. “Oкисно-відновні реакції (ОВР)”
4.1. Вкажіть процеси окиснення:
A) MnO 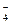 → MnO
→ MnO 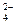 ;
;
B) Br2 → 2Br-;
C) 2H + → H2;
D) Cl- → ClO 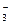 ;
;
E) S → S2-.
4.2. Виберіть окисно-відновні реакції:
A) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O;
B) Fe2O3 + 2Al → Al2O3 + 2Fe;
C) FeSO4 + 2KOH → Fe(OH)2↓ + K2SO4;
D) FeCl2 + Cu → CuCl2 + Fe;
E) 4Fe + 3O2 → 2Fe2O3.
4.3. Виберіть назву процесу і кількість електронів, що бере в ньому участь:
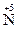 →
→ 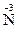
A) окиснення, 5 ē;
B) відновлення, 5 ē;
C) відновлення, 8 ē;
D) окиснення, 8 ē;
E) відновлення, 6 ē.
4.4. Виберіть вірне твердження: максимальний позитивний ступінь окиснення атома елемента дорівнює як правило:
A) номеру періоду;
B) номеру групи;
C) номеру ряду;
D) номеру підгрупи;
E) порядковому номеру елемента.
4.5. Вкажіть речовину, у якій Сульфур може бути лише відновником:
A) H2S;
B) SO2;
C) S;
D) H2SO4;
E) K2S2O8.
4.6. Зазначте ступінь окиснення Фосфору у сполуці H4P2O7:
A) -3;
B) + 4;
C) -5;
D) + 5;
E) -4.
4.7. Зазначте ступінь окиснення Йоду у сполуці H5IO6:
A) -2;
B) 0;
C) + 5;
D) -7;
E) + 7.
4.8. Вкажіть речовину, у якій ступінь окиснення Нітрогену дорівнює -1:
A) NH3;
B) N2H4;
C) NO;
D) N2O;
E) NH2OH.
4.9. Вкажіть речовину, в якій Нітроген може бути лише окисником:
A) KNO3;
B) KNO2;
C) NH3;
D) NO2.
4.10. Вкажіть речовину, в якій Нітроген може проявляти окисно-відновну двоїстість:
A) NH3;
B) HNO3;
C) N2O5;
D) NaNO2;
E) NaNO3.
4.11. Вкажіть, яку кількість електронів приєднує Cr2O72- і до якого ступеня окиснення відновлюється Хром в реакції: Cr2O72- + Fe2 + + H + →
A) 7; + 3;
B) 6; + 1;
C) 6; + 3;
D) 5; + 2;
E) 5; + 1.
4.12. Вкажіть, яке середовище необхідно створити, щоб MnO 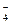 перетворився
перетворився
на Mn2 + :
A) слабкокисле;
B) лужне;
C) нейтральне;
D) слабколужне;
E) кисле.
4.13. Вкажіть, яке середовище необхідно створити, щоб MnO 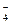 перетворився на MnO
перетворився на MnO 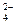 :
:
A) слабколужне;
B) нейтральне;
C) сильнолужне;
D) слабкокисле;
E) сильнокисле.
4.14. Вкажіть, яка з наведених реакцій відноситься до реакцій диспропорціонування:
A) Na + H2O →;
B) Cl2 + KOH →;
C) NaNO3 →;
D) KMnO4 →;
E) CuSO4 + Fe →.
4.15. Вкажіть, скільки іонів Гідрогену бере участь у процесі відновлення
MnO 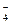 → Mn2 + :
→ Mn2 + :
A) 7;
B) 8;
C) 5;
D) 4;
E) 3.
4.16. Вкажіть, яка з наведених окисно-відновних реакцій відноситься до внутрішньомолекулярних реакцій:
A) KNO2 + FeSO4 + H2SO4 → Fe2(SO4)3 + NO + K2SO4 + H2O;
B) KIO3 + KI + H2SO4 → I2 + K2SO4 + H2O;
C) H2O2 + H2S → H2SO4 + H2O;
D) AgNO3 → Ag + NO2 + O2;
E) NO2 + H2O → HNO2 + HNO3.
4.17. Визначте стехіометричні коефіцієнти у рівнянні окисно – відновної реакції:
Zn + H3AsO3 + HCl → ZnCl2 + AsH3↑ + H2O.
4.18. Визначте стехіометричні коефіцієнти у рівнянні окисно – відновної реакції: As2S3 + HNO3 + H2O → H3AsO4 + H2SO4 + NO↑.
4.19. Визначте стехіометричні коефіцієнти у рівнянні окисно – відновної реакції: Fe(CrO2)2 + O2 + K2CO3 → Fe2O3 + K2CrO4 + CO2↑.
4.20. Визначте стехіометричні коефіцієнти у рівнянні окисно – відновної
реакції: FeS2 + HNO3 + HCl → FeCl3 + H2SO4 + NO↑ + H2O.
4.21. Вкажіть продукти окисно-відновної реакції: NaI + NaNO2 + H2SO4 →
A) NaNO3;
B) H2O;
C) NO;
D) Na2SO4;
E) HNO3;
F) HNO2;
G) I2;
H) HI.
4.22. Вкажіть продукти окисно-відновної реакції: K2MnO4 + K2S + H2SO4 →
A) H2S;
B) S;
C) KMnO4;
D) K2SO4;
E) MnSO4;
F) H2MnO4;
G) HMnO4;
H) H2O.
4.23. Вкажіть продукти окисно-відновної реакції: MnSO4 + (NH4)2S2O8 + H2O →
A) H2MnO4;
B) HMnO4;
C) MnO2;
D) (NH4)2SO4;
E) H2SO4;
F) H2S2O3;
G) S;
H) H2S.
4.24. Розрахуйте фактор еквівалентності окисника окисно –відновної реакції:
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3 Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
A) 1;
B) 1/2;
C) 1/3;
D) 1/4;
E) 1/6.
4.25. Розрахуйте фактор еквівалентності відновника окисно –відновної реакції:
5KNO2 + 3H2SO4 + 2 KMnO4 → 5KNO3 + K2SO4 + 2MnSO4 + 3H2O
A) 1;
B) 1/2;
C) 1/3;
D) 1/4;
E) 1/5.
4.26. Виберіть найсильніший окисник:
A) Br2 /2Br- 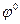 = + 1,087В;
= + 1,087В;
B) ClO 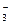 /Cl-
/Cl- 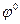 = + 1,450 В;
= + 1,450 В;
C) IO 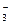 /I
/I 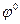 = + 0,260 В;
= + 0,260 В;
D) MnO2/Mn2 + 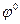 = + 1,288 В;
= + 1,288 В;
E) H2O2/2H2O 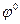 = + 1,776 В.
= + 1,776 В.
4.27. Виберіть найсильніший відновник:
A) SO 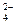 /SO
/SO 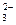
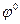 = -0,932 В;
= -0,932 В;
B) SO  /H2S
/H2S 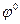 = + 0,31 В;
= + 0,31 В;
C) H3PO4/H3PO3 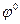 = -0,276 В;
= -0,276 В;
D) S/H2S 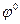 = + 0,144 В;
= + 0,144 В;
E) SO 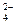 /S
/S 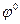 = + 0/357 В.
= + 0/357 В.
4.28. Вкажіть величину, знак якої визначає можливість перебігу окисно-відновної реакції:
A) іонний добуток води;
B) електрорушійна сила;
C) ступінь гідролізу;
D) константа рівноваги;
E) стандартний електродний потенціал.
4.29. Виберіть вірне твердження: KMnO4 – сильний окисник, при зміні рН середовища з 2 до 0 його окисні властивості:
A) зменшаться;
B) збільшаться;
C) не зміняться;
D) перетворяться на відновні властивості.
4.30. Вкажіть, як при зміні рН середовища зміняться відновні властивості FeSO4:
A) збільшаться;
B) зменшаться;
C) не зміняться;
D) перетворяться на окисні властивості.
4.31. Вкажіть, як з підвищенням температури зміняться окисні властивості К2Сг2О7:
A) зменшаться;
B) не зміняться;
C) збільшаться;
D) перетворяться на відновні властивості.
4.32. Виберіть умови, при яких протікає пряма окисно-відновна реакція:
A)  ;
;
B) 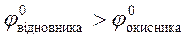 ;
;
C) 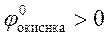 ;
;
D)  ;
;
E) 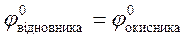 .
.
4.33. Виберіть електрод порівняння, відносно якого визначають електродні потенціали:
A) стандартний хлорсрібний;
B) стандартний скляний;
C) стандартний водневий;
D) стандартний металевий;
E) стандартний ртутний крапельний.
4.34. Використовуючи електрохімічний ряд стандартних електродних потенціалів металів виберіть реакцію, яка не може відбуватися:
A) Zn + 2NaOH + 2Н2О = Na2[Zn(OH)4] + Н2↑;
B) 2А1 + 6НС1 = 2А1С13 + 3Н2↑;
C) 2К + 2Н2О = 2КОН + Н2↑;
D) Cu + 2НС1 = СиС12 + Н2↑;
E) Fe + 2НС1 = FeCl2 + Н2↑.
4.35. Вкажіть сполуку, при електролізі водного розчину та розплаву якої утворюються однакові продукти:
A) КС1;
B) Na2SO4;
C) Н2O;
D) СuСl2;
E) КОН.
4.36. Руйнування металу в середовищі електроліту з утворенням всередині системи електричного струму називається:
A) електролізом;
B) окисненням;
C) електрохімічною корозією;
D) відновленням;
E) гальваностегією.
4.37. При електролізі водного розчину КІ не утворюється:
A) К;
B) КОН;
C) H2;
D) I2;
E) H2O.
4.38. Вкажіть закони, якими кількісно описуються процеси електролізу:
A) Нернста;
B) Фарадея;
C) Вант-Гоффа;
D) Кольрауша;
E) Освальда.
4.39. Розрахуйте електродний потенціал 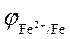 в 0,01 М розчині FeСl2:
в 0,01 М розчині FeСl2:
A) -0,382В;
B) + 0,382 В;
C) - 0,499 В;
D) - 0,440 В;
E) + 0,499 В.
4.40. Розрахуйте електрорушійну силу алюміній-мідного гальванічного елементу у стандартних умовах:
A) + 2,000 В;
B) - 2,000 В;
C) -1,320В;
D) +1,340 В;
E) -1,663В.
4.41. Вкажіть номера іонів відповідно черзі їх окиснення на аноді:
1) Cl-, 2) OH-, 3) S2-, 4) SO42-.
A) 1, 2, 3, 4;
B) 2, 1, 3, 4;
C) 3, 1, 2, 4;
D) 3, 2, 1, 4;
E) 3, 1, 4, 2.
4.42. Напишіть номера сполук відповідно черзі відновлення їх іонів металів на катоді: 1)А1Сl3; 2)СаС12; 3) CuCl2; 4)NaCl; 5) ZnCl2
A) 3, 5, 1, 2, 4;
B) 3, 5, 4, 2, 1;
C) 3, 5, 2, 4, 1;
D) 3, 5, 2, 1, 4;
E) 3, 5, 4, 1, 2.
4.43. Виберіть формулу речовини, при електролізі водного розчину якої на катоді виділяється метал: 1) Hg(NO3)2; 2) Al(NO3)2; 3) Mg(NO3)2; 4) KNO3; 5) Ca(NO3)2:
A) 5;
B) 3;
C) 4;
D) 2;
E) 1.
4.44. Bкажіть, при електролізі водних розчинів яких сполук на катоді буде виділятися водень: l) CuSO4; 2) Na2SO4; 3) NiSO4; 4) H2SO4; 5)NaOH:
A) 1;
B) 2;
C) 3;
D) 4;
E) 5.
4.45. Виберіть схему реакції, яка протікає в зворотному напрямку:
A) Ag+ + Fe → Fe2+ + Ag;
B) Au +Cu2+ → Au3+ + Cu;
C) Zn + Fe2+ → Fe + Zn2+;
D) Mn + Cd2+ → Mn2+ + Cd;
E) Mg + Cu2+ → Mg2+ + Cu.
4.46. Виберіть формулу речовини, при електролізі водного розчину якої на обох електродах відбувається розклад води:
A) Zn(NО3)2;
B) NaCl;
C) K2SO4;
D) CuCl2;
E) А1С13.
4.47. Виберіть формулу речовини, при електролізі водного розчину якої на аноді окиснюються аніони солі:
A) Cd(NO3)2;
B) Na2SO4;
C) NaHCO3;
D) KC1;
E) K2SO3.
4.48. Розрахуйте кількість газу, що утвориться на катоді при електролізі 0,5 моль води:
A) 0,25 моль;
B) 0,50 моль;
C) 0,75 моль;
D) 1 моль;
E) 1,25 моль.
4.49. Розрахуйте масу міді, що виділиться на катоді при пропусканні через розчин CuSO4 струму 5А протягом 20 хвилин:
A) 2,005 г;
B) 1,975г;
C) 1,225 г;
D) 1,004г;
E) 2,125г.
4.50. Розрахуйте об'єм водню, що виділився на катоді при електролізі водного розчину КОН, якщо на аноді виділилося 2,8 л кисню (н.у.):
A) 2,8 л;
B) 11,2л;
C) 22,4 л;
D) 5,6 л;
E) 16,8л.
4.51. Вкажіть, який процес відбувається при електролізі водного розчину AgNO3 на срібному аноді:
A) 2Н2О + 2ē =H2↑+ 2ОН-;
B) 2Н2О =O2↑ + 4+ + 4ē;
C) 2Н2О = Н2 + 2ОН-;
D) Ag = Ag+ + ē;
E) Ag+ + ē = Ag.
4.52. Виберіть схему електролізу розплаву СаС12:
A) СаС12 = Са2+ + 2Cl-;
B) СаС12 = Са + 2С1;
C) СаС12 = Са + С12↑;
D) СаС12 + Н2О = СаО + С12↑ + Н2↑;
E) СаС12 + 2Н2О = Са(ОН)2 + С12↑ + Н2↑.
ЗМІСТОВИЙ МОДУЛЬ 5.
ХІМІЯ ЕЛЕМЕНТІВ – НЕМЕТАЛІВ
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 780; Нарушение авторских прав?; Мы поможем в написании вашей работы!