
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 20. Елементи VIIIA групи 1 страница
Історія відкриття елементів VIIIA групи. Їх місце в періодичній системі і електронна структура атомів. Пояснення неможливості існування двохатомних молекул з позицій метода МО. Потенціали іонізації. Находження в природі, способи їх виділення, властивості, застосування. Найважливіші сполуки, їх властивості, одержання.
Тести дo модуля 5. “Хімія елементів - неметалів”
5.1. Вкажіть елемент, найбільш поширений у космосі:
A) Гідроген;
B) Карбон;
C) Оксиґен;
D) Силіцій;
E) Ферум.
5.2. Вкажіть тип зв'язку між атомами в молекулі водню:
A) Ван-дер-Ваальсовий;
B) водневий;
C) іонний;
D) ковалентний неполярний;
E) ковалентний полярний.
5.3. Вкажіть, чим відрізняється Ортогідроґен від Парагідроґену:
A) орієнтацією спінів ядер;
B) температурою кипіння;
C) температурою плавлення;
D) хімічними властивостями;
E) числом нейтронів.
5.4. Вкажіть відсоток Дейтерію в природному Гідроґені:
A) 0,015%;
B) 1,523%;
C) 2,122%;
D) 99,122%;
E) 99,999%.
5.5. Вкажіть кількість молекул, що міститься в 1г Дейтерію:
A) 22,4;
B) 7,5·1022;
C) 1,5·1023;
D) 3·1023;
E) 6·1023.
5.6. Ізотоп Літію з атомною масою 6 - одне з основних промислових джерело для виробництва Трітію. Запишіть рівняння реакції, на якому ґрунтується ця технологія:__________________________.
5.7. Установіть відповідність між частинками Х у рівняннях ядерних реакцій і їх формулами:
Рівняння реакцій: Х:
A) 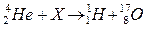 ; 1)
; 1)  ; 4)
; 4)  ;
;
B) 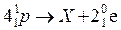 ; 2)
; 2) 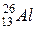 ; 5)
; 5) 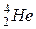 ;
;
C)  ; 3)
; 3) 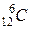 ; 6)
; 6)  .
.
5.8. Вкажіть усі можливі ступені окиснення Гідроґену:
A) -2;
B) -1;
C) 0;
D) + 1;
E) + 2;
F) + 3.
5.9. Вкажіть кількість розпушуючих і зв’язуючих орбіталей в молекулі Н2:
A) дві зв’язуючі орбіталі;
B) одна зв’язуюча орбіталь;
C) одна зв’язуюча і одна розпушуюча орбіталі;
D) одна розпушуюча орбіталь;
E) одна розпушуюча орбіталь, дві зв’язуючі.
5.10. Вкажіть гідриди, що мають іонний зв’язок:
A) CaH2;
B) H2S;
C) HCl;
D) NaH;
E) NH3.
5.11. Вкажіть, який із гідридів найбільш термічно стійкий:
A) AsH3;
B) BiH3;
C) NH3;
D) PH3;
E) SbH3.
5.12. Вкажіть продукти, що утворюються при електролізі водного розчину натрій хлориду за нормальних умов (електроди платинові, густина струму на катоді та аноді 1А/дм2):
A) Na, Cl2;
B) Na, Cl2; H2;
C) Na, O2, HCl;
D) NaOH, Cl2, H2;
E) NaOH, HCl.
5.13. Вкажіть реакції, в результаті яких утворюється H2:
A) Ca + H2O®;
B) Zn + H2SO4(конц.)®;
C) Zn + H2SO4(розб.)®;
D) Zn + HNO3(розб.)®;
E) Zn + HNO3(конц.)®.
5.14. Допишіть рівняння реакції, розставте коефіцієнти:
__Al + __NaOH + __H2O®_______________ + __H2.
5.15. Вкажіть промислові способи виробництва водню:
A) взаємодія перегрітої водяної пари з залізом;
B) взаємодія цинку з хлоридною кислотою;
C) електроліз водного розчину KOH;
D) електроліз дистильованої води;
E) конверсія метану.
5.16. Допишіть рівняння реакції конверсії чадного газу:
C__ + __O®C___ + ___.
5.17. Вкажіть, на якій взаємодії ґрунтується утворення водневого зв’язку:
A) дисперсійній;
B) донорно-акцепторній між атомом Гідрогену та атомом іншого більш електронегативного елементу;
C) донорно-акцепторній взаємодії між двома атомами з однаковою електронегативністю;
D) електростатичній взаємодії;
E) утворенні "електронного газу".
5.18. Вкажіть гідриди, що проявляють кислотні властивості в водних розчинах:
A) B2H6;
B) H2Te;
C) HCl;
D) NH3;
E) SiH4.
5.19. Вкажіть, в якій з наведених реакцій водень виявляє властивості окисника:
A) 2Na + H2 ® 2NaH;
B) Cl2 + H2 ® 2HCl;
C) CuO + H2 ® H2O + Cu;
D) F2 + H2 ® 2HF;
E) N2 + 3H2 ® 2NH3.
5.20. Вкажіть об’єм (н.у.) водню, який необхідно для відновлення Феруму із ферум(ІІІ) оксиду масою 3,19г:
A) 0,224л;
B) 1,34л;
C) 2,24л;
D) 22,4л;
E) 44,8л.
5.21. Запишіть графічну формулу гідроген пероксиду: ______________.
5.22. Допишіть рівняння реакції та розставте коефіцієнти:
___H2O2 + __CrCl3 + ___KOH ® ___K2CrO4 + __H2O + _____.
5.23. Допишіть рівняння і розставте коефіцієнти в реакції, що ілюструє відновлювальні властивості гідроґен пероксиду:
_____ + __AuCl3®____ + ___HCl + ____.
5.24. Допишіть рівняння і розставте коефіцієнти в реакції, що відбувається при відновленні ферум (ІІІ) оксиду воднем:
____ + __H2®___Fe + ___H2O.
5.25. Допишіть рівняння реакції, що відбувається за температури 500-700ºС:
__Li + H2®____.
5.26. Зазначне будову зовнішнього електронного шару атома Флуору:
A) 3s23p53d0;
B) 2s22p5;
C) 5s25p55d0;
D) 4s24p54d0;
E) 6s26p56d0.
5.27. Визначте, як змінюються в ряду F-Cl-Br-I-At значення відносних електронегативностей (ВЕН) та спорідненості до електрону (СЕ) атомів:
A) ВЕН зростає, СЕ зростає;
B) ВЕН зростає, СЕ зменшується;
C) ВЕН зменшується, СЕ зростає;
D) ВЕН зменшується, СЕ зменшується;
E) ВЕН і СЕ не змінюються.
5.28. Визначте, як змінюються в ряду F - -Cl - -B - -I - -At- значення радіусів іонів:
A) зростають;
B) зменшуються;
C) зростають, потім зменшуються;
D) зменшуються, потім зростають;
E) не змінюються.
5.29. Порівняйте міцність зв’язку атомів в молекулах F2, Cl2 та Br2:
A) зв’язок F-F міцніший, ніж зв’язок Cl-Cl;
B) зв’язок F-F міцніший, ніж зв’язок Br-Br;
C) зв’язок F-F слабкіший, ніж зв’язок Cl-Cl, але міцніший ніж Br-Br;
D) зв’язок F-F міцніший, ніж зв’язок Cl-Cl,але слабкіший ніж зв’язок Br-Br;
E) зв’язок F-F слабкіший, ніж зв’язки Cl-Cl або Br-Br.
5.30. Вкажіть формулу флуоровмісного мінералу плавикового шпату (флюориту):
A) NaF;
B) KF;
C) CaF2;
D) Na3AlF6;
E) 3Ca3(PO4)2 · CaF2.
5.31. Визначте, чим зумовлена винятково велика хімічна активність фтору:
A) великим розміром атома Флуора;
B) малим значенням відносної електронегативності Флуору;
C) слабкою міцністю зв’язків Флуору з іншими елементами (Е-F);
D) високою міцністю зв’язків Флуору з іншими елементами (Е-F);
E) високою міцністю зв’язку F-F.
5.32. Вкажіть, чим зумовлена асоціація молекул HF у рідкому і газоподібному станах (і, відповідно, найвища температура кипіння HF порівняно з іншими галогеноводнями):
A) наявністю ковалентних неполярних зв’зків;
B) наявністю ковалентних полярних зв’зків;
C) наявністю водневих зв’язків;
D) наявністю донорно-акцепторних зв’зків;
E) наявністю іонного зв’язку.
5.33. Зазначте найстійкішу ступінь окиснення для Хлору:
A) -1;
B) + 1;
C) + 3;
D) + 5;
E) + 7.
5.34. Вкажіть формулу хлоровмісного мінералу сильвініту:
A) NaCl;
B) KCl;
C) KCl · NaCl;
D) KCl · MgCl2 · 6H2O;
E) KCl · MgSO4 · 3H2O.
5.35. Вкажіть промисловий спосіб добування хлору:
A) HCl(конц) + MnO2 ®;
B) HCl(конц) + KMnO4 ®;
C) KMnO4 + NaCl + H2SO4 ®;
D) електроліз водного розчину NaCl;
E) HCl(конц) + CaOCl2 ®.
5.36. Виберіть хімічні речовини, з якими хлор безпосередньо не взаємодіє:
A) O2;
B) N2;
C) P;
D) Na;
E) Sb.
5.37. Виберіть рівняння хімічної реакції, в якій Хлор виявляє властивості відновника:
A) H2 + Cl2 ® 2HCl;
B) 2Fe + 3Cl2 ® 2FeCl3;
C) 2FeCl2 + Cl2 ® 2FeCl3;
D) 2NaCl + H2SO4(конц) ® 2HCl + Na2SO4;
E) MnO2 + HCl(конц) ® MnCl2 + Cl2 + 2H2O.
5.38. Вкажіть, як змінюються відновні властивості у ряду HCl - HBr - HI:
A) посилюються;
B) посилюються, а потім послаблюються;
C) послаблюються;
D) послаблюються, а потім посилюються;
E) не змінюються.
5.39. Вкажіть, як змінюються у ряду HF - HCl – HBr – HI сила кислот і стійкість молекул кислот:
A) сила кислот і стійкість молекул кислот зростають;
B) сила кислот зростає, стійкість молекул кислот зменшується;
C) сила кислот і стійкість молекул кислот зменшуються;
D) сила кислот зменшується, стійкість молекул кислот зростає;
E) сила кислот зменшується, стійкість молекул кислот не змінюється.
5.40. Вкажіть рівняння реакцій, за допомогою яких можна одержати хлор в лабораторних умовах:
A) HCl(конц) + CaF2 ®;
B) NaClO + NaI + H2O ®;
C) HCl(конц) + KMnO4 ®;
D) HClO + H2O2 ®;
E) HCl(конц) + MnO2 ®.
5.41. Визначте продукти реакції Cl2 + H2O <-->:
A) HCl;
B) HClO;
C) HClO2;
D) HCl + HClO;
E) HCl + HClO2.
5.42. Зазначте продукти взаємодії KOH(хол.) + Cl2 ®:
A) KCl + H2O;
B) KClO + H2O;
C) KClO2 + H2O;
D) KCl + KClO + H2O;
E) KCl + KClO2 + H2O.
5.43. Зазначте продукти взаємодії KOH(гар.) + Cl2 ®:
A) KCl + H2O;
B) KClO2 + H2O;
C) KClO3 + H2O;
D) KCl + KClO2 + H2O;
E) KCl + KClO3 + H2O.
5.44. Вкажіть, як змінюються у ряду HClO – HClO2 – HClO3 – HClO4 сила і окисна здатність кислот:
A) сила і окисна здатність кислот зростають;
B) сила кислот зростає, окисна здатність кислот зменшується;
C) сила кислот і окисна здатність кислот зменшуються;
D) сила кислот зменшується, окисна здатність кислот зростає;
E) сила кислот зменшується, окисна здатність кислот не змінюється.
5.45. Вкажіть назву солей кислоти HClO4:
A) хлорати;
B) хлорити;
C) хлориди;
D) перхлорати;
E) гіпохлорити.
5.46. Визначте, до якого типу солей належить хлорне вапно Ca(ClO)Cl:
A) середніх;
B) кислих;
C) основних;
D) подвійних;
E) змішаних.
5.47. Закінчіть рівняння реакції, розставте коефіцієнти: 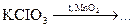
5.48. Закінчіть рівняння реакції, розставте коефіцієнти: 
5.49. Закінчіть рівняння реакції, розставте коефіцієнти: Br2 + Cl2 + H2O ® ...
5.50. Закінчіть рівняння реакції, розставте коефіцієнти: I2 + HNO3(конц) ® …
5.51. Позначте стрілками електрони в графічній схемі електронної будови атома O:

5.52. Вкажіть атомні маси природних ізотопів Оксиґену:
A) 15;
B) 16;
C) 17;
D) 18;
E) 19.
5.53. Вкажіть максимально можливу валентність Оксиґену:
A) 1;
B) 2;
C) 4;
D) 6;
E) 8.
5.54. Вкажіть вміст кисню в повітрі (% об.):
A) 10;
B) 21;
C) 40;
D) 60;
E) 70.
5.55. Вкажіть число неспарених електронів в молекулі O2:
A) 0;
B) 1;
C) 2;
D) 3;
E) 4.
5.56. Вкажіть оксиди:
A) Al2O3;
B) Cl2O7;
C) K2O;
D) Na2O2;
E) Rb2O2.
5.57. Вкажіть тип зв’язку, що виникає між атомами Оксиґену та Гідроґену, які знаходяться в різних молекулах:
A) водневий;
B) дисперсійний;
C) іонний;
D) ковалентний неполярний;
E) ковалентний полярний.
5.58. Вкажіть графічну формулу H2O2, що відображає молекулу з мінімальною внутрішньою енергією:
A) 
B) 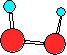 ;
;
C) 
D) 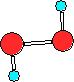 ;
;
E)  .
.
5.59. Вкажіть, яку масу має 1л кисню за нормальних умов:
A)»0,7г;
B)»1.4г;
C)»16;
D)»32;
E)»22,4г.
5.60. Вкажіть, який із оксидів найбільш швидко буде реагувати з водним розчином NaOH за нормальних умов:
A) Al2O3;
B) CaO;
C) CO;
D) CO2;
E) Fe2O3.
5.61. Вкажіть фракції повітря в порядку їх випарювання:
A) CO2;
B) He;
C) N2;
D) Ne;
E) O2.
5.62. Вкажіть, в якій із сполук Оксиген виявляє позитивний ступінь окиснення:
A) H2O2;
B) KO2;
C) KO3;
D) O2;
E) OF2.
5.63. Вкажіть, яка речовина в окисно-відновних реакціях може бути як окисником, так і відновником:
A) CO2;
B) CrO3.
C) PbO2;
D) SO2;
E) SO3.
5.64. Вкажіть речовини, при взаємодії з якими кисень проявляє окисні властивості:
A) Ca;
B) Cl2;
C) FeO;
D) NO;
E) S.
5.65. Вкажіть несолетворний оксид:
A) CuO;
B) N2O;
C) Na2O;
D) P2O5;
E) SO3.
5.66. Вкажіть промислові способи отримання кисню:
A) електроліз водного розчину KOH;
B) електроліз водного розчину KCl;
C) електроліз дистильованої води;
D) ректифікація рідкого повітря;
E) термічним розкладанням нітратів.
5.67. Вкажіть оксид - ангідрид нітратної кислоти:
A) N2O;
B) N2O4;
C) N2O5;
D) NO;
E) NO2.
5.68. Вкажіть основний оксид:
A) Cr2O3;
B) CrO3;
C) Mn2O7;
D) MnO;
E) MnO2.
5.69. Вкажіть речовини, при термічному розкладанні яких в лабораторії може бути отриманий кисень:
A) CaCO3;
B) Cu(NO3)2;
C) KClO3;
D) KMnO4;
E) KNO3.
5.70. Літій пероксид використовують для очищення повітря від вуглекислого газу на підводних човнах та космічних кораблях. Запишіть рівняння реакції, на якій ґрунтується ця технологія: __________________________
5.71. Вкажіть оксид, який не вступає в реакцію з водою:
A) SiO2;
B) K2O;
C) CaO;
D) CrO3;
E) N2O5.
5.72. Вкажіть речовину, при розкладанні якої буде отриманий максимальний об’єм кисню (н.у.) за умови, що маси речовин однакові:
A) BaO2;
B) Cu(NO3)2;
C) KClO3;
D) KMnO4;
E) KNO3.
5.73. Виберіть схеми в яких продуктом реакції є H2O2:
A) BaO2 + CO2 + H2O®
B) BaO2 + H2O(на холоді)®;
C) KMnO4 + H2O®;
D) Na2O2 + H2O(на холоді)®;
E) Na2O2 + KMnO4 + H2SO4®.
5.74. Вкажіть продукти хімічної реакції: KI + O3 + H2O:
A) I2;
B) I2O5;
C) KIO;
D) KOH;
E) O2.
5.75. Вкажіть продукти хімічної реакції: BaO2 + H2SO4:
A) BaS;
B) BaSO4;
C) H2O;
D) H2O2;
E) H2S.
5.76. Вкажіть продукти хімічної реакції: H2S2O8 водний розчин + H2O:
A) H2O2;
B) H2S;
C) H2SO3;
D) H2SO4;
E) O2.
5.77. Вкажіть, які із реакцій окиснення можуть бути проведені без застосування каталізаторів:
A) 2NH3 + 4O2®2NO + 6H2O;
B) 2NO + O2®2NO2;
C) 2SO2 + O2®2SO3;
D) 4NH3 + 3O2®2N2 + 6H2O;
E) S + O2®SO2.
5.78. Вкажіть реагент, який використовують для якісного виявлення озону:
A) CaI2;
B) H2SO4;
C) І2;
D) КMnО4;
E) КІ.
5.79. Зазначте будову зовнішнього електронного шару атома Сульфуру:
A) 5s25p45d0;
B) 2s22p4;
C) 3s23p43d0;
D) 4s24p44d0;
E) 6s26p46d0.
5.80. Визначте, як змінюються в ряду O – S – Se – Te значення радіусів атомів та відносних електронегативностей (ВЕН) атомів:
A) радіуси атомів збільшуються, ВЕН зростає;
B) радіуси атомів збільшуються, ВЕН зменшується;
C) радіуси атомів зменшуються, ВЕН зростає;
D) радіуси атомів зменшуються, ВЕН зменшується;
E) радіуси атомів збільшуються, ВЕН не змінюється.
5.81. Вкажіть формулу сульфуровмісного мінералу піриту:
A) ZnS;
B) Cu2S;
C) HgS;
D) FeS2;
E) PbS.
5.82. Вкажіть найбільш стійку при кімнатній температурі алотропну модифікацію Сульфуру:
A) моноклінна сірка;
B) ромбічна сірка;
C) пластична сірка;
D) пурпурна сірка;
E) оранжева сірка.
5.83. Вкажіть склад молекули найбільш стійкої при кімнатній температурі алотропної модифікації Сульфуру:
A) S2;
B) S4;
C) S6;
D) S8;
E) S∞.
5.84. Визначте промислове джерело добування сірки шляхом термічного розкладу сульфуровмісного мінералу:
A) FeS2;
B) Cu2S;
C) PbS;
D) ZnS;
E) HgS.
5.85. Вкажіть найбільш стійку гідрогеновмісну сполуку елементів VIА групи:
A) H2Se;
B) H2Te;
C) H2Po;
D) H2O;
E) H2S.
5.86. Зазначте, до яких продуктів дигідроенсульфід окиснюється у розчині при взаємодії з сильними окисниками:
A) S;
B) SO2;
C) SO3;
D) SO32-;
E) SO42-.
5.87. Закінчіть рівняння реакції, розставте коефіцієнти:
H2S + K2Cr2O7 + H2SO4 ® S + …
5.88. Виберіть сульфіди, які розчиняються в сильних кислотах - неокисниках:
A) FeS;
B) CuS;
C) ZnS;
D) MnS;
E) PbS.
5.89. Визначте продукти реакції взаємодії кадмій сульфіду при нагріванні з розведеною нітратною кислотою, розставте коефіцієнти:
CdS + HNO3 ® ….. + ….. + Cd(NO3)2 + H2O
|
|
Дата добавления: 2014-11-29; Просмотров: 656; Нарушение авторских прав?; Мы поможем в написании вашей работы!