
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Відповіді на тести 2 страница
|
|
|
|
| 6.1. | С |
| 6.2. | В |
| 6.3. | B,E |
| 6.4. | С |
| 6.5. | В |
| 6.6. | В |
| 6.7. | В |
| 6.8. | А,В,С |
| 6.9. | В,D |
| 6.10. | А |
| 6.11. | С |
| 6.12. | В,С |
| 6.13. | А |
| 6.14. | А,D |
| 6.15. | А,В,С |
| 6.16. | А,В,D |
| 6.17. | B,C,D |
| 6.18. | C |
| 6.19. | A,B,D,Е |
| 6.20. | A |
| 6.21. | C |
| 6.22. | C |
| 6.23. | A3,B2,C1,D4,E5 |
| 6.24. | В |
| 6.25. | А |
| 6.26. | B |
| 6.27. | B,С, |
| 6.28. | B |
| 6.29. | B,С |
| 6.30. | А, D |
| 6.31. | B |
| 6.32. | B,C,D |
| 6.33. | B |
| 6.34. | B |
| 6.35. | С |
| 6.36. | Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2 |
| 6.37. | D |
| 6.38. | A,C |
| 6.39. | A |
| 6.40. | C |
| 6.41. | 2CaS + 2H2O = Ca(HS)2 + Ca(OH)2 |
| 6.42. | Ca(HCO3)2 + Na2CO3 = CaCO3↓ + 2NaHCO3 |
| 6.43. | CaCO3 + 2HCl = CaCl2 + H2CO3 |
| 6.44. | E |
| 6.45. | D |
| 6.46. | A |
| 6.47. | B |
| 6.48. | D |
| 6.49. | A |
| 6.50. | A |
| 6.51. | B |
| 6.52. | A |
| 6.53. | C |
| 6.54. | C |
| 6.55. | С |
| 6.56. | C, D |
| 6.57. | B,D |
| 6.58. | B, C |
| 6.59. | 2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl |
| 6.60. | 2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaCl |
| 6.61. | B,C,D |
| 6.62. | 2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2↑ |
| 6.63. | Al4C3 + 12H2O = 4Al(OH)3 + 3CH4 |
| 6.64. | A, C, E |
| 6.65. | D |
| 6.66. | A |
| 6.67. | 2Ga + 6H2O + 6NaOH = 3H2↑ + 2Na3[Ga(OH)6] |
| 6.68. | B |
| 6.69. | A,B,E |
| 6.70. | A,C,D,E |
| 6.71. | Al2(SO4)3 + 3Ca(HCO3)2 = 3CаSO4 + 2Al(OH)3↓ + 6CO2↑ |
| 6.72. | E |
| 6.73. | A |
| 6.74. | B |
| 6.75. | А,D,E |
| 6.76. | А |
| 6.77. | E |
| 6.78. | 2Cu2O + Cu2S = 6Cu + SO2↑ |
| 6.79. | 3Cu + 8HNO3= 3Cu(NO3)2+ 2NO↑+ 4H2O |
| 6.80. | 2AgNO3 + 2NaOH= Ag2O + 2NaNO3 + H2O |
| 6.81. | AuCl + 2KCN = K[Au(CN)2] + KCl |
| 6.82. | 2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + 2Na2SO4 + CO2↑ |
| 6.83. | D |
| 6.84. | A |
| 6.85. | A |
| 6.86. | B |
| 6.87. | A |
| 6.88. | A |
| 6.89. | A-3, B-2, C-1 |
| 6.90. | A-3, B-4, C-2, D-1, E-5 |
| 6.91. | 4Au + 8NaCN + 2H2O + O2 = 4Na[Au(CN)2] + 4NaOH |
| 6.92. | Au + HNO3 + 4HCl = H[AuCl4] + NO↑ + 2H2O |
| 6.93. | A |
| 6.94. | B |
| 6.95. | 2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au↓ |
| 6.96. | B, C |
| 6.97. | E |
| 6.98. | B |
| 6.99. | A |
| 6.100. | В |
| 6.101. | Д |
| 6.102. | Е |
| 6.103. | А,С |
| 6.104. | Е |
| 6.105. | В,Д,Е |
| 6.106. | Zn + 2HCl + 4H2O = [Zn(H2O)4]Cl2 + H2↑ |
| 6.107. | 3CdS + 8HNO3 = 3Cd(NO3)2 + 2NO↑ + 3S↓ + 4H2O |
| 6.108. | Hg(NO3)2 + 4KI = K2[HgI4] + Hg↓ + 2KNO3 |
| 6.109. | 3HgS + 8HNO3 + 12HCl = 3H2[HgCl4] + 3H2SO4 + 8NO↑ + 4H2O |
| 6.110. | В |
| 6.111. | А |
| 6.112. | А,В,Д,Е |
| 6.113. | А,В,Е |
| 6.114. | 2TiOCl2 + Zn + 4HCl = 2TiCl3 + ZnCl2 + 2H2O |
| 6.115. | 2Ti + 6HF = 2TiF3 + 3H2↑ |
| 6.116. | ZrO2 + CaCO3 = CaZrO3 + CO2↑ |
| 6.117. | HfF4 + 2NaF = Na2[HfF6] |
| 6.118. | А,В,С,Е |
| 6.119. | С |
| 6.120. | А,Д,Е |
| 6.121. | В,С |
| 6.122. | 2Nb + 11H2SO4 = 2[NbO(SO4)3] + 5SO2↑ + 8H2O |
| 6.123. | 3V + 5HNO3 + 18HF = 3H[VF6] + 5NO↑ + 10H2O |
| 6.124. | V2O5 + 6HCl = 2VOCl2 + Cl2↑ + 3H2O |
| 6.125. | 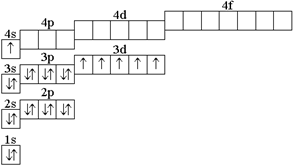
|
| 6.126. | 
|
| 6.127. | D, E |
| 6.128. | E |
| 6.129. | C |
| 6.130. | E |
| 6.131. | Cr2O3 + Al®Al2O3 + Cr |
| 6.132. | A-3 B-2 C-4 D-1 |
| 6.133. | A - + 6 B - 0 C - + 3 D - + 6 E- + 6 |
| 6.134. | A-2 B-3 С-4 D-1 E-5 |
| 6.135. | 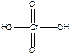
|
| 6.136. | A, B |
| 6.137. | A, D |
| 6.138. | B |
| 6.139. | D |
| 6.140. | B, A, C, D, E |
| 6.141. | B, C, D |
| 6.142. | A, C, D |
| 6.143. | A, Е |
| 6.144. | E |
| 6.145. | A, E |
| 6.146. | B, D, E |
| 6.147. | B |
| 6.148. | E |
| 6.149. | 12MoO42- + 3NH4 + + PO43- + 24H + ® (NH4)3[PO4·12MoO3] ¯ + 12H2O |
| 6.150. | (NH4)3[PO4·12MoO3] + 23NaOH ® NaNH4HPO4 + (NH4)2MoO4 + 11Na2MoO4 + H2O |
| 6.151. | FeWO4 + 4Na2CO3 + O2 ® 4Na2WO4 + Fe2O3 + 4CO2 |
| 6.152. | 
|
| 6.153. | 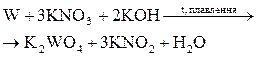
|
| 6.154. | K2CrO4 + H2SO4® K2Cr2O7 + K2SO4 + H2O; 3K2Cr2O7 + H2SO4® 2K2Cr3O10 + K2SO4 + H2O; K2Cr3O10 + H2SO4 ® 3CrO3¯ + K2SO4 + H2O |
| 6.155. | K2CrO4 + Pb(NO3)2 ® PbCrO4¯ + 2KNO3. |
| 6.156. | 2NaCrO2 + 3PbO2 + 8NaOH + 2H2O ® 2Na2CrO4 + 3Na2[Pb(OH)4] |
| 6.157. | Cr2O3 + 3K2S2O7 ® Cr2(SO4)3 + 3K2SO4. |
| 6.158. | K2Cr2O7 + 3(NH4)2S + 4KOH + H2O® 3S¯ + 2K3[Cr(OH)6] + 6NH3 |
| 6.159. | K2Cr2O7 + 3(NH4)2S + H2O ® 2Cr(OH)3 + 3S + 6NH3 + 2KOH |
| 6.160. | Mn

|
| 6.161. | Tc
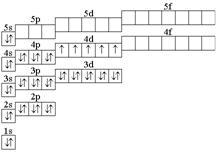
|
| 6.162. | C,D,E |
| 6.163. | D |
| 6.164. | D |
| 6.165. | A-2,B-1,C-4,D-3 |
| 6.166. | E |
| 6.167. | D |
| 6.168. | D |
| 6.169. | A-3, B-1, C-2, D-4 |
| 6.170. | B |
| 6.171. | MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O |
| 6.172. | B) 2MnSO4 + 2H2O → 2H2SO4 + O2↑ + 2Mn↓ C) MnO2 + C → Mn + CO2 D) 3MnO + 2Al → Al2O3 + 3Mn |
| 6.173. | E |
| 6.174. | C,D,B,E,A |
| 6.175. | C |
| 6.176. | B |
| 6.177. | A) Mn(NO3)2 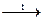 MnO2 + 2NO2↑
C) H2MnO3 → MnO2 + H2O
D) 2KMnO4 + 6KI + 4H2O → 3I2 + 2MnO2↓ + 8KOH MnO2 + 2NO2↑
C) H2MnO3 → MnO2 + H2O
D) 2KMnO4 + 6KI + 4H2O → 3I2 + 2MnO2↓ + 8KOH
|
| 6.178. | C,E |
| 6.179. | B,E,F |
| 6.180. | D |
| 6.181. | D |
| 6.182. | C |
| 6.183. | 3K2MnO4 + 2H2SO4 → 2KMnO4 + MnO2 + 2K2SO4 + 2H2O |
| 6.184. | 2KMnO4 + 3KNO2 + H2O → 2MnO2 + 3KNO3 + 2KOH |
| 6.185. | 2KMnO4 + 5H3PO3 + 3H2SO4 → 2MnSO4 + 5H3PO4 + K2SO4 + 3H2O |
| 6.186. | 2MnSO4 + 5(NH4)2S2O8 + 8H2O → 2HMnO4 + 5(NH4)2SO4 + 7H2SO4 |
| 6.187. | 2KReO4 + 6KI + 16HCl → 2K2[ReCl4] + 4KCl + 3I2 + 8H2O |
| 6.188. | 3Tc2S7 + 14HNO3 → 6HTcO4 + 21S↓ + 14NO↑ + 4H2O |
| 6.189. | A |
| 6.190. | A |
| 6.191. | E |
| 6.192. | C |
| 6.193. | E |
| 6.194. | D,E |
| 6.195. | 2CoCl2 + Ca(OCl)Cl + H2O + 2Ca(OH)2 = 2Co(OH)3↓ + 3CaCl2 |
| 6.196. | B,C |
| 6.197. | B |
| 6.198. | B,C |
| 6.199. | C |
| 6.200. | D |
| 6.201. | D |
| 6.202. | A,D |
| 6.203. | 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 |
| 6.204. | CoCl2 + 7KNO2 + 2CH3COOH = K3[Co(NO2)6] + NO↑ + 2KCl + H2O + 2CH3COOK |
| 6.205. | 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O |
| 6.206. | B,D |
| 6.207. | C,Е |
| 6.208. | B |
| 6.209. | 2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 8H2O |
| 6.210. | 8Sc+30HNO3(розб.) = 8Sc(NO3)3+ 3NH4NO3+9H2O |
| 6.211. | В,D |
| 6.212. | Os + 8HNO3 = OsO4 + 8NO2↑ + 4H2O |
| 6.213. | PtCl4 + 2H2O = H2[PtCl4(OH)2] |
| 6.214. | 3FeCl2 +2K3[Fe(CN) 6] = Fe3[Fe(CN) 6] +6KCl |
ЛІТЕРАТУРА
1. Ахметов Н.С. Общая и неорганическая химия. - М.: Высш. шк., 1998. – 743 с.
2. Василега М.Д. Окислювально – відновні реакції. – К., Рад. шк., 1987. – 152 с.
3. Вступ до хімічної номенклатури /Голуб О.А., Корнілов М.Ю., Скопенко В.В. та ін.-К.: Школяр, 1997. – 48 с.
4. Кудрявцев А.А. Составление химических уравнений. – М.: Высш. шк., 1991. – 320 с.
5. Романова Н.В. Загальна і неорганічна хімія. – К.: Ірпінь: ВТФ «Перун», 1998 г. – 480 с.
6. Скопенко В.В., Григор’єва В.В. Найважливіші класи неорганічних сполук. - К.: Либідь, 1996 р. – 152 с.
7. Скопенко В.В., Савранський Л.В. Координаційна хімія. - К.: Либідь, 2004. - 424 с.
8. Телегус В.С., Бодак О.І., Заречнюк О.С. та ін. Основи загальної хімії. –Львів: Світ, 1998. - 424 с.
9. Угай Я.А. Общая химия. - М.: Высш. шк., 1984 г. – 440 с.
10. Угай Я.А. Неорганическая химия. - М.: Высш. шк., 1989 г. – 463 с.
[1] Тут і далі загальна характеристика елементів підгрупи вивчається за схемою: електронні структури, радіуси атомів, іонізаційні потенціали, спорідненість до електрону, електронегативність, валентні можливості, ступені окиснення, координаційні числа, розповсюдженість в природі; прості речовини: будова, порівняльна характеристика фізичних і хімічних властивостей, характеристика сполук за ступенем окиснення, застосування, біонеорганічна роль.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 950; Нарушение авторских прав?; Мы поможем в написании вашей работы!