
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы иммуноанализа
|
|
|
|
Примерная методика окрашивания клеток в иммунофлуоресцентном тесте
1. Лимфоциты выделяют из гепаринизированной венозной крови центрифугированием на градиенте фиколл - верографина (урографина) (плотность 1,077 г/мл) (Boyum, 1968);
2. Лимфоциты в концентрации 2 млн на 1 мл в объеме 50 мкл вносят в центрифужные пробирки или лунки 96-луночного круглодонного планшета. К клеткам добавляют по 5 мкл раствора тестируемого моноклонального антитела и инкубируют 30-45 мин. при +4 оС;
3. Добавляют 150 мкл раствора Хенкса и центрифугируют 5 мин. при 200 g;
4. Удаляют супернатант. Затем вносят 50 мкл раствора Хенкса, клетки суспендируют, добавляют 150 мкл мкл раствора Хенкса и центрифугируют 5 мин. при 200 g;
5. Удаляют супернатант. К осадку отмытых клеток добавляют 50 мкл F(ab)2-фрагментов овечьих антител к Ig мыши, меченных ФИТЦ и разведенных 1:100. Для разведения используют физиологический раствор, забуференный фосфатами (PBS), содержащий 0,5% желатины и 0,1% азида натрия (вместо PBS можно использовать раствор Хенкса). Клетки суспендируют и инкубируют 30 мин при +4 оС;
6. Клетки 2 раза отмывают, как указано в пп. 3-4;
7. Клетки готовы для наблюдения иммунофлуоресценции, но если результаты теста будут учитываться лишь через несколько часов, то клетки необходимо зафиксировать. Для этого после заключительного центрифугирования и удаления супернатанта к осадку клеток добавляют 50 мкл 1% параформальдегида на PBS (можно использовать раствор формалина разведенный 1:40 на PBS). Клетки суспендируют. Фиксированные клетки сохраняют флуоресценцию в течение недели.
Окрашенные клетки анализируют на проточном цитофлуориметре или просматривают с помощью флуоресцентного микроскопа. В последнем случае клетки суспендируют, суспензия переносится на предметное стекло, накрывается покровным стеклом, и препарат просматривается под иммерсией на флуоресцентном микроскопе (объектив х90). Наилучшее качество изображения достигается при использовании окуляров с небольшим увеличением (х3 или даже х1,7). Рекомендуется использовать нефлуоресцирующее иммерсионное масло. Наблюдение следует проводить в затемненном помещении. Количество антиген-позитивных клеток определяют как % флуооресцирующих клеток при просматривании 200 лимфоцитов за вычетом % флюоресцирующих клеток, наблюдаемых в препарате отрицательного контроля. В качестве отрицательного контроля используют препараты, подготовленные аналогичным образом, за исключением того, что вместо моноклональных антител клетки обрабатывают раствором Хенкса или нормальным Ig мыши.
В настоящее время любые молекулы, обладающие антигенными свойствами и присутствующие в исследуемом материале даже в чрезвычайно низких концентрациях, можно выявлять количественно с помощью методов иммунного анализа: радиоиммунного анализа (РИА) и иммуноферментного анализа (ИФА). Приборы для иммунного анализа могут не только «увидеть», но и измерить количество метки, заранее конъюгированной или с антигеном, или с антителом. В качестве меток используют вещества, которые при определенных условиях может зарегистрировать прибор, либо увидеть глаз человека. К ним относятся:
· радионуклиды, в этом случае анализ называют радиоиммунным (РИА);
· ферменты, катализирующие превращение субстрата с образованием цветного или флуоресцирующего продукта. Такие анализы называют иммуноферментными (ИФА) или, как разновидность, иммунофлуоресцентными;
· флуоресцирующие или люминесцирующие вещества и др.
Первые методы иммуноанализа были разработаны в гомогенных вариантах, без разделения компонентов, т.е. в растворе. Но вскоре стали использовать твердую фазу, анализы стали называть твердофазными – с разделением компонентов, или иммуносорбентными (ферментный иммуносорбентный анализ ELISA, от англ. – Enzyme-Linked Immunosorbent Assay). В настоящее время на практике применяют только твердофазные варианты методик ИФА.
Метод радиоиммунного анализа (РИА ) был разработан в начале 70-х годов прошлого столетия. За разработку РИА Розалин Ялоу была удостоена Нобелевской премии. Методы радиоиммунного анализа особенно важны для точного количественного определения низких концентраций (нанограммовые, а иногда пикограммовые количества) самых различных соединений, содержащихся в жидкой среде, в том числе антител, антигенов, цитокинов, растворимых форм рецепторов, белковых и стероидных гормонов и др. Эти методы широко применяются при изучении вирусных антигенов, противовирусных антител, в диагностике аутоиммунных заболеваний, а также для определения циркулирующих иммунных комплексов.
РИА основан на феномене конкуренции определяемого (немеченого) антигена с известным количеством меченого антигена (антиген метят изотопами 131I, 3H) за ограниченное количество специфических к антигену антител, введенных в систему (рис. 53). Чем больше в исследуемой жидкости содержится определяемого антигена, тем меньше меченого антигена свяжется с антителами и, следовательно, больше останется в растворе.
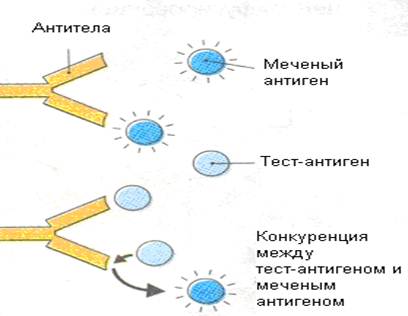
Рисунок 53. Метод конкурентного радиоиммунного анализа
Метод иммуноферментного анализа (ИФА) был предложен менее чем через год после описания РИА тремя независимыми группами исследователей: Engvall и Perlmann в Швеции, van Weemen и Schuur в Нидерландах и Rubenstein с сотрудниками в США. Этот метод основан на том же принципе, что и РИА, но вместо радиоактивной метки используется ферментная (пероксидаза хрена, щелочная фосфатаза, глюкозидаза). Количество меченых антител или антигенов, вступивших в реакцию, определяют на основании изменения окраски субстрата под влиянием фермента. Для считывания результатов ИФА используются автоматические ИФА-ридеры (от англ. read – читать).
С помощью тест-систем ИФА, содержащих поликлональные и особенно моноклональные антитела можно определять общие и специфические иммуноглобулины А, М, G, E, гормоны (как белковой, так и стероидной природы), цитокины, белки сыворотки (в том числе индивидуальные компоненты и фрагменты комплемента и ЦИК), микроорганизмы (вирусы, простейшие, анаэробы и др.), гельминты и многие высокомолекулярные биологические соединения.
В настоящее время ИФА является одним из наиболее часто используемых иммунохимических методов, широко применяемых как в научных, так и в диагностических целях. Например, иммуноферментное определение цитокинов является преимущественным методом по сравнению с другими методами их определения, так как обладает высокой чувствительностью, специфичностью, независимостью от наличия антагонистов и поддается точному автоматизированному учету и стандартизации.
Принцип ИФА заключается в последовательном проведении следующих этапов:
· Сорбция антигена на твердую фазу (например, в лунки полистиролового ИФА-планшета) для выявления антител к нему (либо в сорбции на твердую фазу антител для выявления специфического антигена).
· Внесение в систему (в лунки планшата для ИФА) биопроб, содержащих специфические антитела (или антигены).
· Инкубация смеси в течение определенного времени, в ходе которого происходит специфическое взаимодействие антитела и антигена на твердой фазе; невзаимодействующие компоненты удаляются в процессе отмывания.
· Внесение в смесь фермента (чаще всего пероксидазы), молекулы которого коньюгированы с антивидовыми антииммуноглобулинами (например, кроличьими или козьими антителами к IgG, IgM, IgA человека) и инкубации системы в течение определенного времени.
· Внесение в смесь хромогенного субстрата, каталитически разлагающегося под действием конъюгата фермента с антивидовыми антителами и превращающегося в окрашенное соединение.
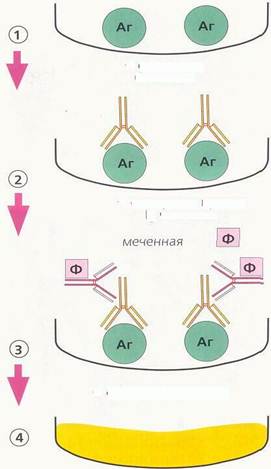
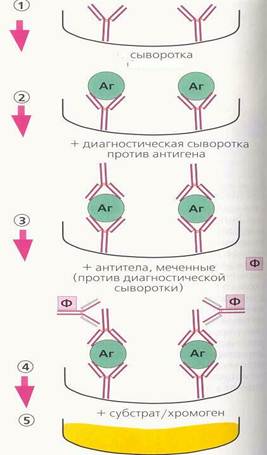
· Регистрирация окрашенного продукта, который выявляется визуально, либо спектрофотометрически: интенсивность окрашивания прямо пропорциональна количеству специфических антител в биопробе (рис. 54).
Существует ряд вариантов постановки ИФА, из которых наибольшее практическое применение получил гетерогенный твердофазный ИФА.
Использование твердой фазы позволяет упростить процесс разделения компонентов реакции за счет иммобилизации одного из компонентов на твердой фазе и легкости удаления соединений, не участвующих в реакции с помощью простого отмывания. Основными требованиями, предъявляемыми к твердой фазе при проведении ИФА, являются высокая воспроизводимость количественных характеристик сорбции компонентов (антигены, антитела), используемых в реакции, и высокая специфическая емкость (т. е. способности сорбировать на своей поверхности антитела или антигены в количествах, необходимых для проведения реакции в сочетании с как можно меньшей неспецифической сорбцией белков из исследуемых образцов и коньюгатов). Наиболее распространенным способом иммобилизации антител или антигенов является физическая адсорбция, при которой соответствующие молекулы присоединяются к поверхности твердой фазы за счет ионных и гидрофобных взаимодействий и водородных связей. Широкое использование стандартной конфигурации 96-луночного планшета позволило унифицировать оборудование, необходимое для проведения иммуноферментного анализа.
| 
|
Рисунок 54. Твердофазный метод ИФА (справа – определение антител в сыворотке, слева – определение антигена в сыворотке)
Постановка. В лунки стрипов вносят по 100 мкл активирующего раствора и инкубируют 30 мин при температуре 370 С. Стрипы во время инкубации помещают в пластиковый пакет. После инкубации содержимое лунок сливают, лунки промывают 3 раза рабочим буферным раствором. В нижние лунки первых двух стрипов вносят по 100 мкл калибровочной пробы, в остальные лунки вносят разведенные образцы анализируемых сывороток по 100 мкл и инкубируют в течение 45 мин при 370С. Затем содержимое лунок удаляют энергичным вытряхиванием и лунки немедленно промывают рабочим буферным раствором 3 раза. Во все лунки вносят по 100 мкл раствора конъюгата, стрипы закрывают и инкубируют в течение 30 мин при 370С. После этого содержимое лунок удаляют вытряхиванием, промывают 3 раза рабочим буферным раствором и осушают. Во все лунки вносят по 100 мкл раствора ОФД, приготовленного непосредственно перед использованием. Стрипы накрывают крышкой и выдерживают при 22±40С вдали от яркого света 25-30 минут. Добавляют по 50 мкл стоп-реагента во все лунки стрипов. Результаты анализа регистрируют фотометрически при длине волны 492 нм. Концентрации иммуноглобулинов в исследуемых образцах определяют, нанося полученные значения оптической плотности на калибровочный график.
Иммуноферментный анализ по сравнению с другими методами выявления антигенов и антител обладает важными преимуществами:
· высокой чувствительностью (существуют варианты ИФА, позволяющие выявлять антитела или антигены в концентрации до нескольких пг/мл);
· возможностью использовать минимум исследуемого материала (например, для проведения всех анализов группы ELISA будет достаточно 0,5 мл сыворотки обследуемого);
· стабильностью реагентов, используемых в работе;
· возможностью автоматизации.
Все эти достоинства определили широкое применение ИФА практически во всех областях современной медицины.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 4890; Нарушение авторских прав?; Мы поможем в написании вашей работы!