
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Колоїдні поверхнево-активні речовини
|
|
|
|
Тип емульсіїлегко встановити за властивостями дисперсійного середовища. Якщо емульсія не змочує гідрофобну поверхню, розбавляється водою, забарвлюється водорозчинним барвником (наприклад, метиленовим синім) і виявляє значну електричну провідність, то це емульсія типу м/в. Навпаки, якщо емульсія змочує гідрофобну поверхню, розбавляється маслом, забарвлюється маслорозчинним барвником (наприклад, суданом III) і не виявляє помітної електричної провідності, то це емульсія типу в/м.
Згідно з другою класифікацією емульсії розділяють на розбавлені – з концентрацією дисперсної фази не більше 0,1 % від об'єму емульсії; концентровані – з концентрацією від 0,1 до 74 % об'єму; висококонцентровані – із вмістом дисперсної фази більшим, ніж 74 % об'єму. 74 % – це максимальна концентрація, коли в емульсії існують недеформовані сферичні краплини. При більшій концентрації відбувається деформування краплин, вони набувають форми багатогранників (поліедрів), розділених тонкими плівками дисперсійного середовища. Під мікроскопом такі емульсії нагадують бджолині соти. Висококонцентровані емульсії мають властивості гелів. Вони не течуть і не здатні до седиментації.
Емульсії, як і всі колоїдні і мікрогетерогенні системи, агрегативно нестійкі внаслідок великого надлишку поверхневої енергії на міжфазній поверхні. Агрегативна нестійкість їх виявляється у самодовільному злипанні крапель – коалесценції, яка може призвести до повного розшарування емульсії. Від коалесценції відрізняється процес оборотної коагуляції – флокуляції, коли утворюються агрегати краплин, які не злипаються, а зберігають свою індивідуальність і при певних умовах знову розходяться.
Седиментація емульсій – спливання або осідання краплин дисперсної фази, залежить від їх дисперсності, різниці густини фаз, в'язкості середовища. Високодисперсні емульсії седиментаційно більш стійкі, ніж грубодисперсні.
Для утворення концентрованої емульсії в системі необхідний емульгатор. Емульгатор знижує поверхневий натяг на межі поділу фаз, отже емульгатор повинен бути поверхнево-активною речовиною, але його дія не вичерпується зменшенням поверхневої енергії. Досвід показує, що коротколанцюгові спирти і жирні кислоти з nс < 8 виявляють слабку емульгуючи дію. Найбільшу емульгуючу здатність мають ПАР з nс від 10 до 18. При подальшому зростанні довжини ланцюга емульгуюча здатність знову слабшає. Отже, існує деяке оптимальне співвідношення гідрофільних і ліпофільних властивостей дифільних молекул ПАР, необхідне для емульгування. Якщо переважає гідрофільність, то молекули ПАР втягуються у воду (рис. 2.6) довголанцюгові ПАР з переважаючими ліпофільними властивостями втягуються у масло, при певному балансі властивостей молекули розташовуються на поверхні поділу фаз. Отже, для вираженої емульгуючої дії необхідна відносна врівноваженість з деяким дебалансом у бік полярності або неполярності. За правилом Банкрофта емульгатори, які краще розчиняються у воді, ніж у маслі, стабілізують прямі емульсії, і, навпаки, якщо розчинність емульгатора у маслі більша, ніж у воді, він стабілізує емульсію типу в/м.
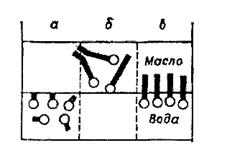
Рис. 2.6. Схема гідрофільно-ліпофільного балансу (ГЛБ): а – зсунутий у бік гідрофільності; б – ліпофільності; в – оптимальний варіант
Співвідношення гідрофільних і ліпофільних властивостей молекул ПАР називають гідрофільно-ліпофільним балансом (ГЛБ). ГЛБ кількісно оцінюють числами, які зростають з підвищенням гідрофільності. Числа ГЛБ ПАР змінюються від 1 до 40. Емульсії типу м/в стабілізують емульгатори з числом ГЛБ 8–8, зворотні емульсії – з числами 3–6. Перші емульгатори називаються гідрофільними, другі –гідрофобними.
Величину ГЛБ знаходять експериментально або за груповими числами атомних угрупувань (довідкова література), що входять в молекулу ПАР. Групове число відображає спорідненість даної групи до води.
Сильну емульгуючу здатність мають мила з nс від 12 до 18 (олеати, стеарати). Вони адсорбуються на міжфазній межі і утворюють структурні шари, звернені йоногенними групами до води, а неполярними ланцюгами –до масла
Крім низькомолекулярних ПАР і порошків, ефективними емульгаторами є високомолекулярні ПАР (желатин, сапоніни, полівінілові спирти і т. д.). Ці речовини утворюють на межі поділу фаз тривимірні сітки. Високомолекулярні емульгатори також підпорядковуються правилу Банкрофта, тому що сітка утворюється завжди з того боку межі поділу, де високомолекулярна ПАР розчинна. Ця рідина і стає неперервною фазою.
Для одержання лікарських емульсій особливо широко застосовуються оксиетильовані неіоногенні ПАР – твіни і плюроніки. Речовини типу плюронік використовуються для одержання дисперсій лікарських препаратів, які вводять у систему кровообігу. Вони були застосовані для емульгування перфторвуглеводнів, запропонованих для переносу кисню у «штучній крові». ПАР типу твін використовують найчастіше у лікарських емульсіях для зовнішнього застосування.
На практиці нерідко виникає необхідність руйнування емульсій. До руйнування призводять часто механічні дії: розмішування і збовтування. Прикладом є одержання вершкового масла при збиванні вершків, центрифугування при відділенні вершків від молока. Розбавлені емульсії можна деемульгувати додаванням електроліту. Руйнування емульсій можна здійснити за допомогою деемульгаторів – ПАР, які мають більшу, порівняно з емульгаторами, поверхневу активність, але меншу здатність до утворення структурованих шарів.
Емульсії мають велике значення у житті людини. Засвоєння жирів у організмі йде через емульгування під впливом жовчі. Молоко, яєчний білок, вершки, сметана, що перебувають в емульгованому стані, добре засвоюються. Емульсії відносять до рідких лікарських форм, що прописують як для зовнішнього, так і для внутрішнього застосування.
У аптеках готують емульсії з насіння та плодів без додавання емульгаторів. Емульгаторами є білки, слизі, камеді, які містяться у насінні і плодах. Масляні емульсії готують з бальзамів, смол, жирних масел з добавкою емульгаторів. До складу масляних емульсій часто входять різні лікарські речовини.
Піни – це висококонцентровані гетерогенні системи, в яких дисперсною фазою є бульбашки газу, а дисперсійним середовищем – рідина або тверде тіло. Якщо дисперсійним середовищем є рідина, таку систему називають рідкою піною, а якщо тверде тіло – твердою піною. Дисперсійне середовище (рідке або тверде) утворює між бульбашками газу розміром від кількох міліметрів до сантиметра тонкі плівки. Газові бульбашки взаємно стискують одна одну, втрачають правильну сферичну форму, а сама піна набуває комірчастої структури, подібної до сот. Така структура пін наближує їх до висококонцентрованих емульсій.
Як і всі системи, що мають надлишок вільної поверхневої енергії, піни термодинамічно нестійкі. Стійкість їх оцінюють за часом, протягом якого самочинно руйнується стовп піни на половину початкової висоти, а також за часом «життя» бульбашки газу.
Як правило, піни одержують методом диспергування. Для цього посудину частково заповнюють рідиною і збовтують, або інтенсивно її перемішують. Рідина захоплює повітря, внаслідок чого на її поверхні утворюється піна. Для утворення пін використовують також барботування, при якому газ пропускають у рідину крізь перфоровану перегородку. Цей спосіб використовують при пінній флотації для збагачення цінних руд.
Піни можна одержати також конденсаційним методом, при якому внаслідок перебігу хімічної реакції у рідині утворюється газоподібна фаза.
У чистих рідинах газові бульбашки швидко коалесціюють і піна практично не утворюється. Стійку піну можна одержати тільки за наявності стабілізатора – піноутворювача, від природи і концентрації якого в основному залежить час існування піни. Піноутворювачі поділяють на дві групи: І та II роду.
До піноутворювачів першого роду належать нижчі спирти, органічні кислоти тощо. Вони мають малу піноутворюючу здатність, оскільки знаходяться в об'ємі розчину і в адсорбційному шарі в молекулярному стані, не утворюють на поверхні поділу фаз механічно міцних структур, а лише зменшують величину поверхневого натягу і тим самим знижують термодинамічну нестійкість пін. Піни, що містять такі стабілізатори, нестійкі і швидко руйнуються.
Піноутворювачами другого роду є мила, алкалоїди, таніни, деякі барвники. Піни з цими стабілізаторами стійкі, оскільки вони адсорбуються на поверхні поділу фаз і утворюють міцні драглеподібні плівки.
Важливою характеристикою пін є їх кратність β тобто відношення об'єму піни V п= VГ + VР до об'єму розчину VР:
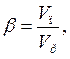
де V п – об'єм піни, а Vр – об'єм розчину.
Важливою характеристикою пін є так званий час життя окремої газової бульбашки, або час руйнування стовпа піни певної висоти, що є характеристиками стійкості піни. Ці величини визначають експериментальним шляхом.
Піни та явище піноутворення мають важливе практичне значення, їх використовують у процесах флотації, для інтенсифікації виробничих процесів, для гасіння пожеж, при очищенні поверхні від забруднень, у харчовій, парфумерній та фармацевтичній промисловостях. Деякі лікарські засоби використовують у вигляді пінних аерозолів та пінних препаратів для лікування опіків, запалень шкіри, як кровоспинні засоби.
Класифікуючи дисперсні системи, ми розподіляли їх на дві групи – ліофільні і ліофобні (оборотні і необоротні). Відомо, що ліофобні дисперсні системі є термодинамічно нестійкими системами. Ліофільні системи термодинамічно стійкі, а це означає, що вони рівноважні (стан відповідає мінімуму енергії Гіббса G), оборотні і утворюються самодовільно як із макрофаз, так і з істинного розчину. Типовими представниками ліофільних дисперсних систем є розчини колоїдних поверхнево-активних речовин.
Колоїдними поверхнево-активними речовинами називають ПАР, здатні утворювати міцелярні системи. Властивості ПАР зумовлені дифільністю їх молекул. У довголанцюгових ПАР з числом атомів вуглецю n с = 10–20, для яких характерний оптимальний баланс гідрофільності і гідрофобності, спостерігаються особливі властивості. При малих концентраціях вони утворюють істинні розчини, із збільшенням концентрації відбувається процес асоціації і утворюються міцели. Цей процес самодовільний, і в системі можливі рівноважні переходи:
Молекулярний Міцелярна Структурована Тверде
розчин ↔ система ↔ міцелярна ↔ тіло
система (гель)
Міцелярний розчин ПАР – це система термодинамічно стійка, рівноважна і оборотна. Міцели ПАР, на відміну від міцел ліофобних золів, термодинамічно стабільні і не змінюються, доки під дією зовнішніх факторів не зсунеться рівновага в системі.
За властивістю дисоціювати ПАР розділяють на йоногенні (аніоноактивні, катіоноактивні, амфотерні) і нейоногенні.
У аніоноактивних ПАР поверхнево-активні йони заряджені негативно. До них належать лужні солі жирних кислот (мила) – RCOOMe, алкілсульфати – сульфоефіри вищих спиртів та їх солі типу R–О–SO3–Me; алкіл- і арілсульфонати RSO3Me – лужні солі високомолекулярних сульфокислот, де R означає вуглеводневий радикал типу СnН2n+1 з числом атомів вуглецю С10–С20, a Me – йони Na+, K+, NH4+.
Катіоноактивні ПАР – це солі амінів, четвертинних амонійних основ, алкілпіридинових сполук. Поверхнево-активні йони таких речовин заряджені позитивно.
Амфотерні ПАР – це алкіламінокислоти RNH2COOH, сульфобетаіни та ін. В залежності від рН вони виявляють аніоно-або катіоноактивні властивості.
Неіоногенні ПАР не дисоціюють на йони. Їх одержують взаємодією оксиду етилену із спиртами, фенолами, жирними кислотами та іншими сполуками з полярними групами. Загальна формула неіоногенних ПАР – R(OCH2CH2)mOH. Гідрофільність їх визначається довжиною оксиетиленового ланцюга. У виробництві фармацевтичних препаратів широко застосовуються оксиетильовані похідні ефірів жирних кислот і сорбітану.
Важливою характеристикою колоїдного ПАР є співвідношення гідрофільних і гідрофобних властивостей, яке визначається числом ГЛБ. В залежності від числа ГЛБ колоїдні ПАР застосовуються як гідрофобні емульгатори (3–6), змочувачі (7–9), миючі засоби (13–15), гідрофільні емульгатори (8–18).
Утворення міцел відбувається при певній концентрації – так званій критичній концентрації міцелоутворення (ККМ). За визначенням ІЮПАК, ККМ – це концентрація ПАР, при якій в його розчині виникає велике число міцел, що перебувають в термодинамічній рівновазі з молекулами (йонами), і різко змінюється ряд властивостей розчинів.
На величину ККМ впливають різні фактори. У гомологічних рядах з підвищенням молекулярної маси ПАР величина ККМ зменшується, бо здатність до асоціації зростає із збільшенням довжини вуглеводневого ланцюга. Електроліти значно знижують ККМ йоногенних ПАР. Головну роль при цьому відіграють йони, заряджені протилежно йону ПАР. Вони знижують заряд міцели, при цьому зменшується електростатичне відштовхування і полегшується приєднання нових молекул до міцели. Підвищення температури підсилює тепловий рух частинок, що перешкоджає їх агрегації. Але у випадку йоногенних ПАР одночасно зменшується гідратація і це сприяє міцелоутворенню.
При концентраціях, відповідних ККМ, у розчинах ПАР утворюються сферичні міцели, або міцели Гартлі. У водних розчинах сферична міцела – це компактне утворення, яке складається із рідкого вуглеводневого ядра, покритого шаром полярних груп. У неводних розчинах виникають зворотні міцели, ядро яких утворюють полярні групи, а вуглеводневі ланцюги звернені до розчинника.
Солюбілізацією називають процес самодовільного розчинення у міцелярних системах нерозчинних у даному розчиннику сполук. Наприклад, у достатньо концентрованих водних розчинах колоїдних ПАР розчиняються органічні речовини, практично нерозчинні у воді: аліфатичні і ароматичні вуглеводні, маслорозчинні барвники і т.д. Солюбілізацію називають також колоїдним розчиненням. Колоїдне розчинення води у неводних розчинах колоїдних ПАР – це зворотна солюбілізація.
В результаті солюбілізації утворюється прозорий термодинамічно рівноважний розчин, який, однак, належить не до істинних, а до колоїдних розчинів, внаслідок того, що він має колоїдний ступінь дисперсності. Речовина, яка розчиняється у міцелярній системі, називається солюбілізатом. Солюбілізація полягає в проникненні солюбілізата в міцелу. Експериментально встановлено, що солюбілізація вуглеводнів зменшується із зростанням довжини ланцюга, а солюбілізуюча здатність ПАР у межах одного гомологічного ряду зростає із збільшенням числа атомів вуглецю.
У фармації солюбілізацію застосовують для одержання водорозчинних препаратів із нерозчинних у воді речовин. Йодофори – це препарати йоду, розчиненого у поверхнево-активних речовинах. Введення ПАР дозволяє одержувати препарати стероїдів для парентерального і зовнішнього застосування. Вітаміни А і Е солюбілізують ефірами сахарози. У оксиетильованих ефірах сорбітану солюбілізуються барбітурати і аспірин.
Застосування колоїдних ПАР пов'язане з їх високою поверхневою активністю, здатністю до змочування, емульгуючою дією, солюбілізацією, здатністю до гелеутворення.
Широко застосовуються ПАР у фармацевтичному виробництві як стабілізатори і солюбілізатори. Лужні солі вищих карбонових кислот використовують як емульгатори, солюбілізатори, стабілізатори мазей і кремів. Катіоноактивні ПАР застосовують як бактерицидні, фунгіцидні, дезинфікуючі засоби. Твіни – це емульгатори, солюбілізатори гормонів, масел, вітамінів, антибіотиків, плюроніки – солюбілізатори вітамінів, антибіотиків, шампунів, зубних паст.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 2289; Нарушение авторских прав?; Мы поможем в написании вашей работы!