
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства
|
|
|
|
Мочевина
Впервые была выделена из мочи, является конечным продуктом распада белков у животных. Взрослый человек в сутки выделяет с мочой 25 – 30 г мочевины.
Мочевина является производным угольной кислоты.
В промышленности мочевину получают:
 Большая часть ее используется в качестве азотного удобрения. Значительное количество ее расходуется на получение мочевиноформальдегидных смол, имеющих большую роль в технике.
Большая часть ее используется в качестве азотного удобрения. Значительное количество ее расходуется на получение мочевиноформальдегидных смол, имеющих большую роль в технике.
Мочевина – бесцветное кристаллическое вещество (т. пл. 133 оС), хорошо растворима в воде, обладает оснóвными свойствами.
Оснóвным центром в мочевине считают атом О. Соли нитрат и оксалат мочевины – твердые вещества, плохо растворимы в воде:

В химическом отношении мочевина проявляет свойства аминов и амидов кислот.
Как амины она образует соли с минеральными и сильными органическими кислотами. Являясь слабым основанием (р, p-сопряжение ослабляет оснóвные свойства), она реагирует только с одним эквивалентом к-ты (р-ции см. выше). Р-ция образования нитрата мочевины используется в клинике для выделения мочевины из мочи.
Взаимодействие с НNO2
При действии НNО2 мочевина, как первичный амин, выделяет N2. Это находит применение для количественного определения мочевины по объему выделившегося азота:
(NH2)2CO + 2HONO ® 2N2 + CO2 + 3H2O
При действии алкилирующих средств получают алкилмочевину:
|
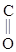 –NH2 + С1 – СН3 ® Н2N–
–NH2 + С1 – СН3 ® Н2N– 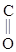 –NH–СН3 + НС1
–NH–СН3 + НС1
Метилмочевина
Образование уреидов
При действии ацилирующих средств (RCO-C1) получают уреиды. Некоторые из них являются лекарственными препаратами.
|
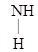 + Cl–CO–CH3
+ Cl–CO–CH3 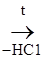 Н2N–CO–NH–
Н2N–CO–NH– 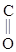 –CH3
–CH3
Ацетилмочевина
СН3– 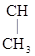 –
– 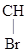 –
– 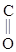 –NHСОNH2
–NHСОNH2
Бромизовал (бромурал) – снотворное средство.
Важное значение имеет уреид мочевины и малоновой кислоты:

Производные барбитуровой кислоты обладают снотворным действием:
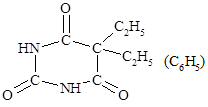
| Диэтилбарбитуровая кислота – веронал, этилфенилбарбитуровая кислота – люминал. |
Гидролиз мочевины
Мочевина гидролизуется в присутствии кислот или щелочей. В организме гидролиз проходит под действием фермента уреазы:
(NH2)2CO + HOH ® CO2 + 2NH3
Образование биурета
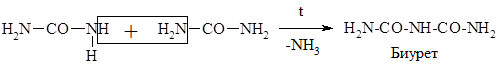
Биурет с Сu(ОН)2 в щелочной среде образует комплексное соединение красно-фиолтового цвета. Эта качественная реакция называется биуретовой, она служит для обнаружения пептидов и белков.
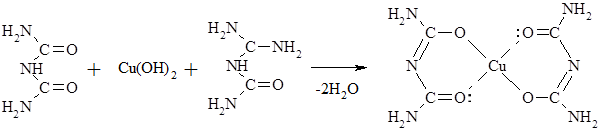
Действие щелочного раствора гипобромита натрия
Происходит выделение N2 и образование угольной кислоты (р-ция А. Гофмана и А. Бородина):
(NH2)2CO + 3NaBrO ® 3NaBr + N2 + CO2 + 2H2O
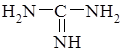
| иминомочевина (гуанидин) входит в состав аминокислоты аргинина |
Н2N – СООН – карбаминовая к-та – неполный амид Н2СО3. В свободном состоянии не существует, однако соли (карбаматы) и эфиры (уретаны) этой к-ты достаточно устойчивы и находят практическое применение. Эфиры являются снотворными средствами.
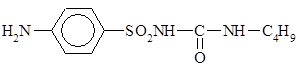
30%-ный раствор мочевины + 10%-ный р-р глюкозы – средство для предупреждения и уменьшения отека мозга.
Вопросы для самоконтроля:
1. Какие соединения называются карбоновыми кислотами.
2. Классификация карбоновых кислот.
3. Виды изомерии карбоновых кислот.
4. Номенклатура карбоновых кислот.
5. Строение карбоновых кислот.
6. Химические свойства карбоновых кислот.
7. Механизмы реакции нуклеофильного замещения, этерификации
8. Двухосновные кислоты (щавелевая, малоновая, янтарная, глутаровая, фумаровая).
9. Химические свойства производных карбоновых кислот – мочевины.
10. Основные реакции метаболизма карбоновых кислот в организме.
Упражнения:
1. Напишите все изомеры общей формулы С4Н8О2. назовите их.
2. Изобразите строение карбоксильной группы. Укажите основные реакционные центры карбоновых кислот.
3. Напишите реакции уксусной кислоты с Са, СаО, Са (ОН)2 и СаСО3.
4. Напишите реакции образования сложного эфира, ангидрида, хлорангидрида и амида уксусной кислоты.
5. Напишите изомеры бутен-2-диовой кислоты.
6. Получите а) кислую и среднюю соль щавелевой кислот, б) полный и неполный амид щавелевой кислоты.
7. Напишите реакции: а) декарбоксилирования малоновой кислоты, б) дегидратация янтарной кислоты, в) дегидратация малеиновой кислоты.
8. Сравните основные свойства мочевины и аминов.
9. Напишите реакции мочевины с: а) HCl, б) хлорангидридом уксусной кислоты, малоновой кислоты.
10. Напишите реакцию образования биурета и качественную реакцию на него.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 13940; Нарушение авторских прав?; Мы поможем в написании вашей работы!