
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторна робота № 5. Розчини електролітів. Електролітична дисоціація. Гідроліз солей
|
|
|
|
Тема 5. Розчини неелектролітів і електролітів
Загальна характеристика розчинів. Розчинення як фізико-хімічний процес. Явище сольватації. Теплові явища під час розчинення. Способи вираження концентрації розчинів.
Розчини неелектролітів. Закони Рауля. Зниження тиску насиченої пари над розчинами порівняно з тиском пари над чистими розчинниками. Підвищення температури кипіння і зниження температури замерзання розчинів. Осмос і осмотичний тиск. Закон осмотичного тиску Вант-Гоффа.
Властивості розчинів електролітів. Теорія електролітичної дисоціації Арреніуса. Електропровідність розчинів. Сильні і слабкі електроліти. Закон розбавляння Оствальда. Дисоціація кислот, основ і солей. Іонні реакції у розчинах електролітів. Дисоціація води. Іонний добуток води і рН водних розчинів. Індикатори. Гідроліз солей.
Мета роботи: вивчення електропровідності розчинів електролітів та її залежності від різних факторів. Вивчення реакцій гідролізу солей різних типів.
Дослід 1. Спостереження електропровідності розчинів

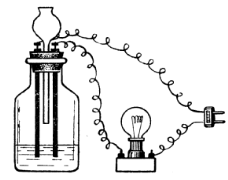 В склянку приладу для спостереженння електропровідності розчинів налити дистильовану воду, занурити електроди і включити прилад в електромережу. Чи засвітилася електролампа? Дослід повторити, перевіряючи електропровідність розчинів спир-ту, цукру, солі, кислоти, лугу, водогінної води. Перед кожним дослідом необхідно ретельно промивати електроди і склянку. Зробити виснов-ки, які речовини є електролітами (слабкими, чи сильними), а які – неелектролітами. Скласти рівняння електролітичної дисоціації даних електролітів.
В склянку приладу для спостереженння електропровідності розчинів налити дистильовану воду, занурити електроди і включити прилад в електромережу. Чи засвітилася електролампа? Дослід повторити, перевіряючи електропровідність розчинів спир-ту, цукру, солі, кислоти, лугу, водогінної води. Перед кожним дослідом необхідно ретельно промивати електроди і склянку. Зробити виснов-ки, які речовини є електролітами (слабкими, чи сильними), а які – неелектролітами. Скласти рівняння електролітичної дисоціації даних електролітів.
Дослід 2. Залежність електропровідності розчину (ступеню дисоціації електроліту) від розведення
В хімічну склянку приладу для спостереження електропровідності розчинів налити мінімальний об’єм (необхідний для занурення електродів) концентрованого розчину CH3COOH. Включити прилад в електромережу та відзначити яскравість світіння електролампи. Кислоту поступово розвести дистильованою водою. Як змінюється яскравість лампи? Дати пояснення на підставі закону розбавляння Оствальда.
Дослід 3. Зміна забарвлення індикаторів в розчинах кислот і лугів
Налити в 3 пробірки по 1 мл дистильованої води і додати розчин нейтрального лакмусу до добре помітного забарвлення. В одну з пробірок з лакмусом додати декілька крапель кислоти, в другу пробірку додати луг. Третю пробірку залишити для порівняння. Спостерігати зміну кольору розчину в перших двох пробірках. Зробити аналогічні досліди з фенолфталеїном та з метиловим оранжевим. Спостереження оформити в таблицю 4, в якій відображено кольори кислотно-основних індикаторів в кислому, лужному та нейтральному середовищах. Написати рівняння реакцій електролітичної дисоціації кислоти і лугу.
Таблиця 4. Забарвлення кислотно-основних індикаторів різних середовищах
| Індикатор | Середовище розчину | ||
| Кисле (рН<7) | Нейтральне (рН=7) | Лужне (рН>7) | |
| Лакмус | |||
| Метилоранж (м/о) | |||
| Фенолфталеїн (ф/ф) |
Дослід 4. Необоротні іонні реакції
а) у творення малорозчинних солей
В три пробірки налити по кілька краплин розчинів різних солей сульфатної кислоти, наприклад, Na2SO4, ZnSO4. В кожну пробірку додати по краплях розчину барій хлориду до утворення осаду. Скласти молекулярні та йонні рівняння. Який йон є реагентом на сульфат-йон?
б) у творення малорозчинних основ
До розчинів нікол сульфату та ферум хлориду додати розчин натрій гілроксиду до утврення осадів нікол та ферум гідроксидів. Написати рівняння реакцій в молекулярному та іонному скороченому вигляді.
в)утворення слабких кислот
До розчинів солей СН3СООNa та Na2S, що знаходяться в різних пробірках, додати по 1 мл сульфатної H2SO4 або хлоридної кислот HCl. Які слабкі кислоти утворилися? Написати рівняння хімічних реакцій в молекулярній і іонній формах.
г) реакції нейтралізації
Налити в пробірку 2-3 мл 2 н розчину лугу і додати краплю фенолфталеїну. В який колір забарвився індикатор? Чому? Потім в пробірку влити 2 н розчин хлоридної кислоти до знебарвлення розчину. Пояснити причину знебарвлення. Написати молекулярне і йонне рівняння реакції нейтралізації лугу кислотою.
Дослід 5. Гідроліз солей різних типів
а) солі, утворені сильною основою та слабкою кислотою
Для досліду взяти одну з солей: CH3COONa, K2CO3, К3РО4. В пробірку з розчином солі внести кислотно-основний індикатор (лакмус, метилоранж, фенолфталеїн) і визначити, кисле чи лужне середовище утворюється при гідролізі солі. Написати рівняння реакцій гідролізу солі.
б)солі, утворені слабкою основою та сильною кислотою
Для досліду взяти одну з солей: NH4Cl, ZnCl2 та Al2(SO4)3. В пробірку з розчином солі внести кислотно-основний індикатор (лакмус, метилоранж, фенолфталеїн) і визначити, кисле чи лужне середовище утворюється при гідролізі солі. Написати рівняння реакцій гідролізу солі.
в)солі, утворені слабкою основою та слабкою кислотою
В пробірку налити 2 мл розчину солі CH3COONH4, або іншої солі цього
типу. Занурити у розчин послідовно синій та червоний лакмусовий папір. Скласти рівняння реакції гідролізу. Який можна зробити висновок?
г) солі, утворені сильною основою та сильною кислотою
В пробірку налити 2 мл розчину однієї з солей: NaCl, K2SO4 та BaCl2. Розчини перевірити нейтральним лакмусом. Чи відбувається гідроліз та зміна кислотності розчину?
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 2489; Нарушение авторских прав?; Мы поможем в написании вашей работы!