
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторна робота 8. Електрохімічні властивості розчинів
|
|
|
|
Тема 8. Полімерні матеріали
Тема 7. Елементи електрохімії
Гальванічні елементи. Електрорушийна сила гальванічного елемента. Електроліз. Анодне окислення та катодне відновлення. Закони Фарадея. Практичне застосування електрохімічних процесів в машинобудівних технологіях та техниці.
Основні види корозії металів. Типи корозійних руйнувань. Хімічна та електрохімічна корозія. Анодні і катодні процеси. Катодна деполяризація. Залежність корозії від зовнішних умов. Захист від корозії.
Загальна характеристика полімерних матеріалів. Реакції полімеризації. Основні типи зв`язків і атомних груп, що визначають здатність до полімеризації, або до поліконденсації. Ступінь полімеризації. Фізико-хімічні властивості полімерів. Термопластичні та термореактивні полімери.Лінійні і просторові полімери. Фізико-хімічні характеристики окремих полімерів, їх застосування в техніці.
Мета роботи: ознайомлення з роботою гальванічних елементів. Вивчення процесів електролізу розчинів солей та корозії металів.
Дослід 1. Гальванічний елемент Даніеля-Якобі
В одну склянку налити до половини її об’єму 1 М розчин цинк сульфату, а в другу – 1 М розчин купрум сульфату. В першу склянку опустити цинкову пластину, до якої прикріплено дріт, у другу – аналогічний цинковому мідний електрод. Дроти від металевих пластинок приєднати до гальванометра. Розчини солей у склянках з’єднати електролітним містком. Чим пояснити відхилення стрілки гальванометра? Користуючись таблицею стандартних потенціалів, обчислити стандартну ЕРС цього гальванічного елемента.
Дослід 2. Електроліз водних розчинів солей з інертними електродами
 Налити в U – подібний електролізер 5 %-вий розчин CuCl2 і занурити в нього графітові електроди. Приєднати прилад до джерела струму напругою 10 – 20 В (або до акумулятора), приєднати також реостат (на 10–20 Ом) та амперметр. Включити електричний струм. Сила струму повинна бути ~ 2 А. Електроліз продовжити 5–10 хвилин. Скласти рівняння катодного і анодного процесів. До анодного простору додати 2–3 краплі йодкрохмального розчину. Які процеси відбуваються на електродах?
Налити в U – подібний електролізер 5 %-вий розчин CuCl2 і занурити в нього графітові електроди. Приєднати прилад до джерела струму напругою 10 – 20 В (або до акумулятора), приєднати також реостат (на 10–20 Ом) та амперметр. Включити електричний струм. Сила струму повинна бути ~ 2 А. Електроліз продовжити 5–10 хвилин. Скласти рівняння катодного і анодного процесів. До анодного простору додати 2–3 краплі йодкрохмального розчину. Які процеси відбуваються на електродах?
Аналогічний дослід можна провести з розчином солі Na2SO4, або КІ. Записати спостереження та реакції, які відбуваються на електродах.
Дослід 3. Корозія при контакті різних металів
В зігнуту під прямим кутом скляну трубку налити розбавленої H2SO4. З протилежних боків внести пластини (або дроти) цинку та міді. На якому металі утворюються бульбашки водню? Що спостерігається при контакті металів? При порушенні контакту між ними? Скласти схему гальванопари.
Дослід 4. Електрохімічна корозія заліза
Налити в дві пробірки по 1/2 їх об’єму розбавленого розчину сульфат-ної кислоти. Додати в кожну по три краплі розчину K3[Fe(CN)6]. В двох канцелярських залізних скріпках закріпити шматочок олова та шматочок цинку. Занурити по одній з цих скріпок в кожну пробірку. Спостерігати за дослідом декілька хвилин. На основі теоретичних передумов зробити висновок, який з цих металів захищає залізо від електрохімічної корозії. В якій з цих пробірок з’являється синє забарвлення? При цьому треба враховувати, що синє забарвлення виникає в процесі взаємодії K3[Fe(CN)6] з солями двовалентного феруму за реакцією:
6FeSO4 + 2K3[Fe(CN)6] = 3K2SO4 + Fe3[Fe(CN)4]2 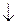
Пояснити, чому в розчині з’явилися іони заліза Fe2+. Яке залізо більш стійке: оцинковане чи луджене?
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 775; Нарушение авторских прав?; Мы поможем в написании вашей работы!