
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розчини
|
|
|
|
Загальні уявлення про розчини
Розчини відіграють надзвичайно важливу роль у здійсненні різноманітних хімічних процесів, що обумовлюють життєдіяльність живих організмів, рослин, протікання багатьох природних явищ.
Розчином називається гомогенна термодинамічно стійка система, що складається з двох або більшої кількості незалежних компонентів, співвідношення між якими можуть змінюватися у широких межах.
Розчини бувають газоподібні, рідкі і тверді. Прикладом газоподібного розчину може бути повітря, рідкого – розчин глюкози у воді, твердого – різноманітні сплави металів.
Кожний розчин складається із розчинника і розчиненої речовини.
Розчинником вважають той компонент, який у чистому вигляді існує в такому ж агрегатному стані, як і розчин. У випадку, коли розчинник і розчинена речовина не відрізняються за агрегатним станом від розчину, розчинником вважається той компонент, який знаходиться у більшій кількості. 3 цієї точки зору, повітря – це розчин кисню, водяної пари, вуглекислого газу, інертних газів в азоті, оскільки вміст азоту в повітрі складає 78%. Етиловий або метиловий спирти необмежено змішується з водою. Тому, в залежності від співвідношення кількостей спирту і води, ця система може бути розчином спирту у воді або води у спирті. По відношенню до кухонної солі, цукру та інших твердих речовин вода буде завжди розчинником.
Треба зазначити, що з усіх існуючих речовин вода є найбільш універсальним розчинником – в ній розчиняється найбільше йонних та полярних речовин. Це пояснюється такою властивістю води як полярність її молекул. Полярність молекули води обумовлюється тим, що на одному кінці її молекули знаходиться атом Оксигену, який відтягує два електрони від атомів Гідрогену, утворюючи негативно заряджений “центр”, а на атомах Гідрогену виникає позитивний заряд. Відстань між позитивно та негативно зарядженими кінцями молекули називають довжиною диполя. У молекули води довжина диполя найбільша, ніж у відомих розчинників.
Найбільше значення в хімії, а також в існуванні навколишнього середовища мають розчини, в яких розчинником є вода. Тому далі мова буде йти в основному про водні розчини.
Характерним є процес розчинення у найбільш поширеній системі: тверда речовина – рідкий розчинник. Молекули твердої речовини знаходяться в стані коливального руху. Коли тверду речовину вносять в рідину, молекули твердої речовини відриваються із кристалічної решітки за рахунок їх коливального руху, з одного боку, і за рахунок притягання диполями розчинника – з іншого. Завдяки дифузії, розчинена речовина рівномірно розподіляється у всьому об’ємі розчинника аж до встановлення рівноваги:
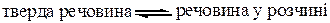
При цій рівновазі зберігається рівність між кількістю молекул, що переходять у розчин і викристалізовуються у тверду фазу за певну одиницю часу. Такий розчин називається насиченим при даній температурі. Розчин, в якому при даній температурі ще можна розчинити додатково певну кількість розчиненої речовини, називається ненасиченим.
Розчинення речовин відбувається в більшості випадків з виділенням або поглинанням тепла, а іноді із зміною об’єму. Це стало підґрунтям виникнення фізичної (Вант-Гофф) та хімічної теорії розчинів (Д. Менделєєв). Тепловий ефект, що супроводжує процес розчинення, відносять до одного моля розчиненої речовини і називають молярною теплотою розчинення.
Теплота розчинення залежить від природи розчиненої речовини і розчинника, а також від температури розчинення.
Тепловий ефект сольватації – це кількість тепла, що виділяється при взаємодії частинок розчиненої речовини з молекулами розчинника і утворенні нових зв’язків між ними. Таким чином, при розчиненні встановлюється рівновага:
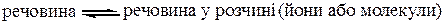 .
.
Швидкість прямого процесу υ1, зворотного – υ2.
Розчинність – процес зворотний. В залежності від умов відбувається або розчинення (υ1>υ2) або виділення з розчину розчиненої речовини (υ1<υ2).
Вода є добрим розчинником полярних сполук, наприклад, амоніаку або етилового спирту, не тільки тому, що їх молекули мають значну полярність, але й тому, що при розчиненні зберігається характер зв’язків, які існували у вихідних компонентах. Замість водневих зв’язків між молекулами кожного компонента (води, амоніаку, спирту) виникають такі ж зв’язки між молекулами розчинника і молекулами розчиненої речовини.
Розчинність більшості твердих речовин збільшується з підвищенням температури. Для газів спостерігається протилежна залежність – з підвищенням температури розчинність газів зменшується. У природі спостерігаються явища замору риби у спекотні дні, тому що зменшується розчинність кисню в воді.
Розчинність найчастіше виражають кількістю грамів розчиненої речовини у 100 г води (не плутати з масовою часткою речовини).
Розчини систематизують також з точки зору дисперсності (подрібненості) розчиненої речовини на молекулярні (істинні), колоїдні та грубодисперсні системи:
а) молекулярні – діаметр розчинених частинок від 10 до 100 нм (1·10-8-1·10-7 см);
б) колоїдні – діаметр частинок 1·10-7-1·10-5 см;
в) грубодисперсні – діаметр частинок більше за 1·10-5 см. Грубодисперсні поділяють на суспензії – тверді частинки в рідині та емульсії – рідке в рідині.
Концентрація розчинів та способи її вираження
Однією з найважливіших характеристик кількісного складу розчинів є їх концентрація.
Концентрацією розчину називається точне кількісне співвідношення компонентів відносно маси або об’єму розчину чи розчинника.
Розчини з великою концентрацією розчиненої речовини називаються концентрованими, з малою – розведеними. Межі між розведеними і концентрованими розчинами досить умовні. Розведені розчини містять невелику частку розчиненої речовини у порівнянні з концентрованими. У деяких випадках насичений розчин може бути досить розведеним, якщо речовина має малу розчинність. Тому для більш повної характеристики розчину, його склад характеризується кількісно. Для одержання нових хімічних речовин та для кількісного аналізу потрібно точно знати концентрацію розчинів, які використовуються. Існує декілька способів вираження складу розчинів.
Масова частка розчиненої речовини – дорівнює відношенню маси речовини до маси розчину і виражається числом, меншим за одиницю, або у відсотках (зустрічається стара назва цього типу концентрації – відсоткова):
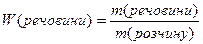 або
або 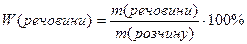
Об’ємна частка розчиненої речовини – дорівнює відношенню об’єму речовини до об’єму розчину і виражається числом, меншим за одиницю, або у відсотках:
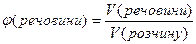 або
або 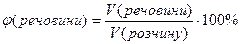
Мольна частка розчиненої речовини – дорівнює відношенню кількості речовини розчиненої сполуки до суми кількостей речовини всіх компонентів і виражається числом, меншим за одиницю, або у відсотках:
 або
або 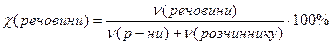
Молярна концентрація розчиненої речовини – дорівнює відношенню кількості речовини до об’єму розчину, має розмірність [моль/дм3 (моль/л)]:
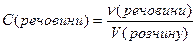
Молярна концентрація еквівалента розчиненої речовини – дорівнює відношенню кількості речовини еквівалента до об’єму розчину, має розмірність [моль/дм3 (моль/л)]:
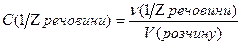
Велика кількість типів концентрації розчинів обумовлюється практичною доцільністю. Так масова частка широко використовується в будівельній, харчовій та інших галузях промисловості. Склад повітря виражають або в масових відсотках, або в об’ємних відсотках. Об’ємні співвідношення також використовують для приготування алкогольних напоїв. (Вино, яке має міцність 12 градусів виготовлена так, що в 100 об’ємах вина міститься 12 об’ємів спирту).
У хімічних лабораторіях застосовують молярну концентрацію. В той же час в аналітичних лабораторіях використовують виключно молярну концентрацію еквівалента (стара назва – нормальна концентрація). Молярна концентрація еквівалента [моль/дм3 (моль/л)] показує кількість моль-еквівалента речовини в 1 літрі розчину.
Колігативні властивості розчинів
Всі хімічні речовини по відношенню їх розчинів та розплавів до електричного струму умовно поділяють на електроліти і неелектроліти:
1. Електроліти – речовини, розчини та розплави яких проводять електричний струм (деякі кислоти та основи, солі).
2. Неелектроліти – речовини, розчини та розплави яких не проводять електричний струм (цукор, спирт, гліцерин та ін.).
Властивості розведених розчинів неелектролітів
Деякі фізичні властивості розведених розчинів неелектролітів залежать від кількості розчинених частинок, а не від їх хімічного складу. Оскільки такі властивості обумовлені колективним впливом розчинених часток, їх називають колігативними або збірними (від латинського соligas – збирати).
До колігативних властивостей відносяться утворення та зміна тиску пари над розчином, підвищення температури кипіння і зниження температури замерзання розчинів, дифузія і осмос.
Колігативні властивості розчинів молекулярних речовин, якими є розведені розчини неелектролітів, пов’язані з числом частинок розчиненої речовини в даній кількості розчинника, тобто з її мольною часткою.
Закони Рауля
Зниження тиску насиченої пари розчинника над розчином
Відомо, що над поверхнею будь якої речовини відбувається випаровування. Тиск пари над поверхнею залежить від температури – при її збільшенні тиск зростає. Якщо розчин помістити у закриту посудину, то через деякий час встановиться рівновага між швидкістю переходу молекул розчинника у пару та зворотнім цьому процесу конденсації пари. Встановлено, що при розчиненні будь-якої нелеткої речовини у певному розчиннику тиск насиченої пари над розчином буде меншим, ніж тиск насиченої пари над чистим розчинником при сталій температурі. Цей факт обумовлений такими властивостями: 1) зменшенням ефективної поверхні випаровування розчину у порівнянні з чистим розчинником, оскільки частину поверхні розчину зайнято нелеткими молекулами розчиненої речовини; 2) взаємодією між молекулами розчиненої речовини і розчинника з утворенням гідратів (розчинник–вода) або сольватів (неводний розчинник), стійкіших, ніж з’єднання молекул розчинника між собою. Якщо позначити тиск пари розчинника Р0, а тиск розчину – Р, то різниця Р - Р0 = ΔР показує величину зниження тиску пари. Відношення цієї різниці до тиску пари розчинника дає так зване відносне зниження тиску пари розчинника:
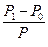
Залежність зниження тиску пари розчинників над розчинами від їх концентрації визначається першим законом Рауля:
Відносне зниження тиску насиченої пари розчинника над розчином дорівнює мольній частці розчиненої речовини.
Математичний вираз цього закону:
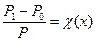 , де
, де
χ(х) – мольна частка речовини у розчині.
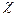 (речовини) =
(речовини) = 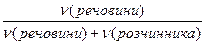 =
= 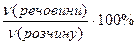
Виходячи з наведеного рівняння, можна обчислити тиск пари розчину, або абсолютне зниження тиску пари ΔР.
Температури замерзання та кипіння розчинів
Температура замерзання – це така температура, при якій тиск пари над рідкою та твердою фазами зрівнюється. Тому, коли починається утворення перших кристалів, то температура залишається постійною до повного замерзання розчину.
Температура кипіння – температура при якій тиск насиченої пари над розчином дорівнює атмосферному тиску.
Всі чисті речовини характеризуються певними температурами замерзання і кипіння. Чиста вода при атмосферному тиску замерзає при 0°С і кипить при 100°С і т. д. Ці температури залишаються незмінними до того часу, поки вся рідина не замерзне або не перетвориться у пару.
Інша справа з розчинами. Наявність розчиненої речовини підвищує температуру кипіння і знижує температуру замерзання розчину тим сильніше, чим більш концентрований розчин. Якщо розчинити у воді будь-яку речовину (цукор, гліцерин), то температура замерзання розчину буде нижча 0°С, а температура кипіння – вища 100°С (рис. 1.2).
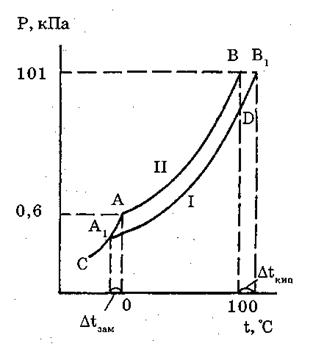
|
Рис. 1.2. Діаграма залежності тиску пари над розчином (І) і над водою (ІІ) від температури
Така залежність є прямим наслідком зниження тиску пари над розчинником. Вода під тиском 101,3 кПа кипить при 100°С тому, що при цій температурі тиск водяної пари дорівнює 101,3 кПа, таку саму величину має атмосферний тиск.
Якщо розчинити у воді будь-яку речовину, то тиск пари води знизиться. Для того, щоб довести тиск пари води над одержаним розчином до 101,3 кПа, потрібно нагріти розчин вище 100°С. Таким чином, зміна температури кипіння розчину залежить від концентрації розчиненої речовини, із зростанням якої знижується тиск пари і підвищується температура кипіння розчину. Аналогічно пояснюється зниження температури замерзання розчинів.
Різниця між температурами кипіння розчину і чистого розчинника називається підвищенням температури кипіння розчину. Різниця між температурами замерзання чистого розчинника і розчину називається зниженням температури замерзання розчину:
Залежність підвищення температури кипіння і зниження температури замерзання розчину подано на діаграмі (рис. 1.2.). Точка А діаграми відповідає тиску пари води і льоду при 0°С, крива АВ – зміні тиску пари води в інтервалі від 0 до 100°С, відрізок АС – зміні тиску пари льоду при зниженні температури нижче нуля, а крива А1В1 – зміні тиску пари розчину від температури замерзання до температури кипіння. При кожній температурі тиск пари розчину менший тиску пари розчинника, тому всі точки кривої А1В1 розміщені нижче відповідних точок АВ. З діаграми видно, що тиск пари розчину при 100°С залишається меншим за атмосферний (точка Б), тому розчин не кипить, тиск досягає атмосферного лише в точці В1(тобто при температурі 100 + Δtзам°С. З діаграми виходить також, що для виділення кристалів льоду з розчину його потрібно охолодити нижче 0°С до Δtзам°С. Таким чином, межі рідкого стану розчину розширені, порівняно з розчинником, на число градусів, що дорівнює сумі підвищення температури кипіння розчину і зниження температури його замерзання.
Ці закономірності визначаються другим законом Рауля: Для розведених розчинів підвищення температури кипіння і зниження температури замерзання пропорційні моляльній концентрації розчинів:
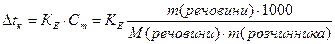
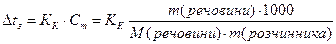
Зниження температури замерзання розчину, де у 1000 г розчинника знаходиться 1 моль розчиненої речовини (молярне зниження) є величина стала для даного розчинника і називається кріоскопічною сталою розчинника (Кк).
Молярне підвищення температур кипіння, тобто підвищення, яке спостерігається при розчиненні 1 моля речовини у 1000 г розчинника, називається ебуліоскопічною константою розчинника (КЕ).
Наприклад, розчин, що містить у 1000 г води 34,2 г цукру (0,1 моль) замерзає при -0,186°С, а якщо у 1000 г води буде розчинено 342 г (1 моль), то температура замерзання такого розчину буде -1,86°С.
В таблиці 1.2 наведено кріоскопічні та ебуліоскопічні константи деяких розчинників.
Таблиця 1.2 – Характеристики процесів кипіння і замерзання деяких розчинів
| Розчинник | tкип. °С | КЕ, град/моль моль | tзам. °С | КК, град/моль |
| Вода | 0,52 | 1,86 | ||
| Бензен | 80,1 | 2,53 | 5,5 | 5,12 |
| Оцтова кислота | 118,1 | 2,93 | 17,0 | 3,9 |
| Нітробензен | 210,8 | 5,27 | 5,8 | 6,9 |
| Ацетон | 56,0 | 1,71 | - | - |
| Етиловий спирт | 78,3 | 1,22 | - | - |
Третій закон Рауля: Розчини, що містять однакові кількості розчинених речовин в однакових кількостях розчинника, мають однакове зниження температур замерзання і однакове підвищення температур кипіння.
Наприклад, при розчиненні у 1000 г води 0,1 моль цукру (34,2 г), або глюкози (18 г), або пероксиду водню (3,4 г) температура замерзання всіх цих розчинів буде складати -0,186°С.
На законах Рауля засновано визначення молярних мас деяких речовин.
Явище зниження температури замерзання розчинів використовується для приготування так званих антифризів – розчинів, що замерзають лише при нижчих температурах, ніж температура замерзання води. Їх застосовують в установках, що працюють при низьких температурах, а також для охолодження двигунів. Як антифризи використовують водні розчини етиленгліколю, гліцерину, спиртів та інших органічних сполук.
Дифузія і осмос
У дуже розведених розчинах неелектролітів молекули розчиненої речовини практично не взаємодіють між собою, оскільки середня відстань між ними велика у порівнянні з їх власними розмірами. Поведінка цих молекул в розчині аналогічна поведінці ідеального газу. Аналогія з газом виявляється, наприклад, у здатності розчиненої речовини рівномірно розподілятися в об’ємі розчину. Процес самочинного вирівнювання концентрації розчину внаслідок теплового руху молекул розчиненої речовини і розчинника називається дифузією.
Одностороння дифузія (осмос). Це особливе явище в системі, яка складається з двох розчинів з різною концентрацією розділених напівпроникною перетинкою (мембраною або діафрагмою), через яку проходять молекули розчинника і не проходять молекули розчиненої речовини завдяки різницям у розмірах. У такому випадку дифузія буде односторонньою. Тобто молекули розчинника будуть рухатись з розчину з меншою концентрацією у розчин з більшою концентрацією.
Процес односторонньої дифузії молекул розчинника через напівпроникну перетинку називається осмосом, а тиск, що є причиною осмосу, називається осмотичним тиском.
Спостерігання осмосу і вимірювання осмотичного тиску здійснюється за допомогою спеціального приладу – осмометра (рис.1.3). Найпростіший осмометр складається із скляної трубки, розширений кінець якої щільно закритий напівпроникною мембраною. За скляною трубкою закріплюється калібрований в одиницях тиску екран. У трубку заливають досліджуваний розчин (наприклад, розчин цукру у воді) таким чином, щоб була заповнена розширена частина. Трубку занурюють у посудину з розчинником (у даному випадку вода) на таку глибину, щоб рівні рідин в обох посудинах співпали. Через деякий час рівень рідини в трубці підніметься і досягне певної висоти. (виникне гідростатичний тиск). Між гідростатичним тиском і осмотичним тиском розчину існує прямо пропорційна залежність.
Голландський хімік Вант-Гофф встановив закон осмотичного тиску: “Осмотичний тиск розчину чисельно дорівнює тиску, який чинила б розчинена речовина, якби вона при тій самій температурі перебувала в газоподібному стані і займала об’єм, що дорівнює об’єму розчину”. Математично закон Вант-Гоффа записується так:
π = СRТ, де
π – осмотичний тиск, Па;
С – молярна концентрація розчину, моль/дм3;
R – універсальна газова стала, Дж/моль·К;
Т – абсолютна температура за Кельвіном.
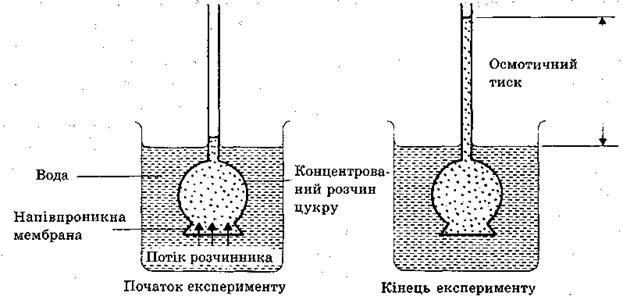
Рис.1.3. Схема дії осмометру
За допомогою цього рівняння можна обчислювати осмотичний тиск розчинів неелектролітів, знаходити молярні маси розчинених речовин. Але слід враховувати, що закон Вант-Гоффа може бути застосований лише для розведених розчинів.
Осмотичні ефекти мають велике значення в природі, життєдіяльності живих організмів. Всі біологічні тканини складаються з клітин, оболонки яких напівпроникні. Через них легко проходять молекули води, а молекули інших речовин – вибірково. Завдяки цьому у клітинах створюється осмотичний тиск, який надає пружності тканинам органів. Якщо клітину помістити в розчин, в якому концентрація розчинених речовин буде вища, ніж у клітині (гіпертонічний розчин), почнеться перехід води з клітини в розчин, і вона почне зморщуватися. Таке явище має назву плазмоліз у рослин.
При вміщенні клітини у розчин з нижчою концентрацією розчинених речовин (гіпотонічний розчин) спостерігається перехід води в клітину, збільшується її об'єм. Цей процес одержав назву гемоліз.
Осмотичний тиск крові, лімфи, інших тканин людини і тварин дорівнює осмотичному тиску розчину натрій хлориду з масовою часткою 0,9%. Такі розчини називаються ізотонічними розчину натрій хлориду з масовою часткою 0,9%. Він не викликає будь-яких змін у клітинах і називається "фізіологічним розчином". У техніці зворотній осмос (рух молекул води з концентрованого розчину у розведений під дією підвищеного зовнішнього тиску) використовують для очищення стічних вод, опріснення морської води тощо.
Властивості розведених розчинів електролітів
Колігативні властивості розчинів електролітів не підлягають законам Рауля та Вант-Гоффа, оскільки при дисоціації концентрація частинок розчиненої речовини зростає, наприклад, BaCl2 → Ba2+ + 2Cl- – з однієї частинки утворюється три частинки. Вант-Гофф запропонував ввести поправковий множник і – ізотонічний коефіцієнт:
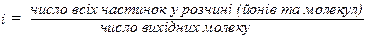
Для проведення розрахунків для розчинів електролітів формули законів Рауля та Вант-Гоффа треба доповнити даними таблиці 1.3.
Таблиця 1.3 – Співвідношення формул законів Рауля та Вант-Гоффа
| Для неелектроліта | Для електроліта |
| Δtз=kmc(x) | Δtз=іkmc(x) |
| Δtк=εmc(x) | Δtк=іεmc(x) |
| π=cRT | π=іcRT |
Для пояснення поведінки речовин у розчинах електролітів була запропонована теорія електролітичної дисоціації:
1. Розчинення електроліту супроводжується його розпадом на йони, які поділяють на катіони і аніони. Катіони – позитивно заряджені йони. Аніони – негативно заряджені йони.
2. Дисоціація – процес оборотний, одночасно з утворенням йонів відбувається асоціація (моляризація).
3. Йони утворюють з водою нестійкі сполуки, які називаються гідрати, а з неводними розчинниками – сольватами. Причому процеси дисоціації та гідратації (сольватації) відбуваються одночасно.
Розпад речовин на йони може відбуватись під впливом молекул розчинника – це електролітична дисоціація, під впливом температури – це термічна дисоціація та під впливом різних видів випромінювання – фотолітична дисоціація.
Електролітична дисоціація – це розпад молекул електролітів на йони під впливом полярних молекул розчинника.
Розрізняють два процеси, які протікають при розчиненні електролітів у воді – дисоціацію та іонізацію.
Процес дисоціації відбувається лише по місцю розташування йонного зв’язку при наявності йонної кристалічної решітки. Йонізація молекул проходить за місцем розташування сильнополярного ковалентного зв’язку (H-ОNO2). Це пояснюється тим, що лише поряд з такими зв’язками існують заряди на атомах здатні зруйнувати структуру води та зорієнтувати її диполі навколо зарядів. Біля кожного зв’язку орієнтується декілька диполів води.
Процес електролітичної дисоціації можна розбити на такі етапи:
1. Орієнтація диполів води відносно позитивно та негативно заряджених йонів відповідним полюсом.
2. Утворення зв’язків між йоном та молекулами води (йон-дипольна взаємодія) – це екзотермічний процес, тому що утворюються нові зв’язки між частинками, а саме – частково гідратований йон.
3. Відрив йонів від кристалічної гратки – (ендотермічний процес) та утворення повністю гідратованого йона, оточеного диполями води.
4. Дифузія гідратованого йона у розчин.
Йонізація має схожий механізм, але додається ще один важливий етап: після орієнтації молекул води відносно позитивних та негативних полюсів молекул речовини, що розчиняється, відповідним полюсом відбувається додаткова поляризація молекули за місцем розташування сильнополярного ковалентного зв’язку, розтягування зв’язку та розрив з утворенням йонів.
Кількість позитивних та негативних йонів у розчині завжди рівна, тобто всі розчини електронейтральні. За здатністю до дисоціації електроліти поділяються на сильні та слабкі. Сильні електроліти у розчинах дисоціюють повністю, навіть у розчинах з великою концентрацією вони існують у вигляді йонів. Сильні електроліти: водні розчини лугів; розчини хлорної, сульфатної, нітратної, йодидної, бромидної, хлоридної кислот; солі. Сильні електроліти навіть при великих концентраціях надають розчину значну електропровідність.
Незалежно від кількості йонів, з яких складається молекула сильного електроліту (солі або основи), дисоціація відбувається в одну стадію:
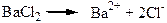
Розпад на йони молекул слабких електролітів – оборотний процес. Прямий процес – дисоціація (йонізація), оборотний – утворення молекул з йонів (асоціація). У розчинах слабких електролітів встановлюється рівновага між процесами йонізації та асоціації йонів у молекули:
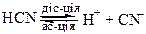
Це означає, що швидкість процесу дисоціації дорівнює швидкості процесу асоціації. Тобто у той час, як наприклад 100 молекул речовини розпадеться на йони – дисоціація, утвориться з йонів інші 100 молекул – асоціація.
До слабких електролітів відносять сульфатну (IV), нітратну (ІІІ), сульфідну, ацетатну, карбонатну, ціанідну кислоти, нерозчинні основи та солі, які мають ковалентні зв’язки: Hg(CN)2, Fe(SCN)3, NH4CN, NH4SCN та ін. Розчини слабких електролітів при високих концентраціях мають низьку електропровідність, яка при розведенні значно зростає.
Слабкі електроліти, молекули яких складаються з трьох та більше йонів, дисоціюють (йонізують) у декілька стадій (ступінчасто):
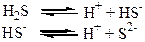
Не можна плутати розчинність речовини та її належність до сильних або слабких електролітів. Наприклад, АgСl має дуже низьку розчинність у воді. Але вся незначна кількість солі, яка знаходиться у розчині, існує у вигляді йонів Аg+ та Сl-, тому аргентум хлорид відносять до сильних електролітів.
Так як процес йонізації зворотній, у розчинах слабких електролітів завжди присутні як йони, так і молекули. Тому для нього можна записати константу рівноваги за законом діючих мас. Вона називається константою дисоціації:

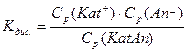 , де
, де
Кдис. – константа дисоціації;
Ср(Kat+), Cp(An-), Cp(KatAn) – відповідні рівноважні молярні концентрації катіонів, аніонів, речовин.
Тобто Кдис. дорівнює відношенню добутку молярних рівноважних концентрацій йонів до молярної рівноважної концентрації недисоційованих молекул.
Константа дисоціації характеризує здатність електроліту дисоціювати на йони. Чим більше константа дисоціації, тим краще електроліт розпадається на йони. Кожна стадія характеризується своєю константою дисоціації (йонізації). Константа дисоціації існує лише для слабких електролітів. Константу дисоціації речовин можна знайти у довідниках.
Поряд з константою дисоціації стан слабкого електроліту у розчині характеризує ступінь дисоціації – a. Вона кількісно характеризує цей процес, і може бути виражена у відсотках та частках від 1:
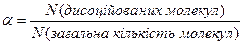
Розведення розчину зменшує вірогідність зустрічі йонів, тому ступінь дисоціації слабких електролітів збільшується, збільшується кількість заряджених частинок, які здатні переносити електричний струм.
Закон розведення Оствальда
Так як дисоціація слабких електролітів – оборотний процес, то для нього існує рівновага між йонами та молекулами і у рівняння для константи рівноваги можна ввести ступінь дисоціації:
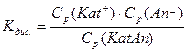
Якщо ступінь дисоціації a, то концентрація йонів дорівнює:
Ср(Кat+) = Ср(Аn-) = aС, де С – вихідна концентрація речовини,
а концентрація молекул, що непродисоціювали:
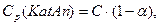
тоді константа рівноваги
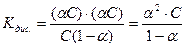
Це формула закону розведення Оствальда. Вона пов’язує між собою константу рівноваги, ступінь дисоціації та молярну концентрацію.
Коли значення a малі можна вважати 1-a≈1, то вираз закону розведення спрощується:
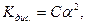
звідки
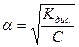
і тоді
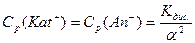
З закону розведення виходить, що із зростанням концентрації розчину знижується ступінь дисоціації розчиненого електроліту, але концентрація йонів у розчині збільшується.
Визначення основних класів неорганічних сполук з точки зору теорії електролітичної дисоціації
Кислоти – це електроліти, які при дисоціації утворюють катіони лише одного виду – Гідрогену, та аніони кислотного залишку. Сила кислот залежить від кількості йонів Гідрогену, які вони утворюють при дисоціації:
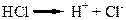
Основи – це електроліти, які при дисоціації утворюють катіони металу, та аніони лише одного виду – гідроксид-іони:
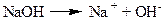
Солі – це електроліти, які при дисоціації утворюють катіони металу та аніони кислотного залишку:
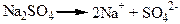
Електролітична дисоціація – це важливий розділ загальної хімії. З дією процесів дисоціації ми зустрічаємось у природі та у промисловості. Наприклад, одним з правил протипожежної безпеки є таке – не можна гасити електричні мережі водою, якщо не вимкнутий струм, тому, що питна та природна вода має досить високу електропровідність за рахунок дисоційованих у ній солей. У нашому організмі більшість процесів протікає за рахунок руху йонів, наприклад, передача нервових імпульсів. У медицині використовують електролітичну дисоціацію у процесах електрофорезу. Світовий океан – це продукт дисоціації речовин земної кори під впливом води. рН середовища, яке обумовлює напрямок багатьох хімічних процесів, є наслідком дисоціації молекул води.
Дисоціація води. рН.
Навіть ретельно очищена від домішок вода зберігає незначну електропровідність. Це зумовлено дисоціацією води на йони:
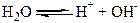
Велике значення має утворення зв’язків між молекулами води та йонами розчиненої речовини. Особливо міцно взаємодіють молекули води з йонами Гідрогену:
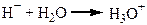
Потім йон гідроксонію гідратується трьома молекулами води.
Рівновага дисоціації води встановлюється практично миттєво. При 22° С у дистильованій води рівноважні концентрації такі:
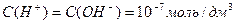
Це означає, що вода дуже слабкий електроліт – лише одна з 10 мільйонів молекул води дисоційована.
При розчиненні у воді речовин, що утворюють йони Гідрогену, або гідроксид-йони, концентрація молекул води має зменшуватися, але вона лишається майже сталою, бо ступінь дисоціації води дуже малий.
Тому спрощено константа дисоціації води (йоний добуток) має вигляд:
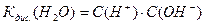
Коли ми підставимо подані вище концентрації йонів Н+ та ОН- знаходимо:
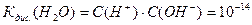
Саме йони утворені при дисоціації молекул води визначають характер середовища: кисле, лужне, нейтральне.
Реакція середовища у водних розчинах визначається такими даними:
С(Н+) >·С(ОН-) – кисле середовище;
С(Н+)·= С(ОН-) – нейтральне середовище;
С(Н+)·< С(ОН-) – лужне середовище.
Розчинення у воді кислот збільшує концентрацію йонів Н+ і зменшує концентрацію йонів ОН- тому, що 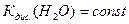 . При розчиненні основ навпаки збільшується концентрація йонів ОН- і зменшує концентрацію йонів Н+. В усіх розчинах добуток С(Н+)·С(ОН-) залишається сталим. Наприклад, у розчині хлоридної кислоти з концентрацією 0,1 моль/дм3 С(Н+) = 1 10-1 моль/дм3, а С(ОН-) = 1·10-13 моль/дм3, в розчині натрій гідроксиду з концентрацією 0,1 моль/дм3 С(Н+) = 1·10-13 моль/дм3, а С(ОН-) = 1 10-1 моль/дм3.
. При розчиненні основ навпаки збільшується концентрація йонів ОН- і зменшує концентрацію йонів Н+. В усіх розчинах добуток С(Н+)·С(ОН-) залишається сталим. Наприклад, у розчині хлоридної кислоти з концентрацією 0,1 моль/дм3 С(Н+) = 1 10-1 моль/дм3, а С(ОН-) = 1·10-13 моль/дм3, в розчині натрій гідроксиду з концентрацією 0,1 моль/дм3 С(Н+) = 1·10-13 моль/дм3, а С(ОН-) = 1 10-1 моль/дм3.
Так як концентрації йонів це дуже малі цифри, то для зручності, для характеристики середовища розчинів замість справжньої концентрації йонів Гідрогену користуються її від’ємним десятичним логарифмом – водневим показником – рН:
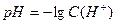 .
.
У нейтральних розчинах рН = 7, у кислих розчинах рН < 7, а в лужних рН > 7.
Аналогічно розраховують рОН, величину, яка протилежна рН і залежить від концентрації гідроксид-іонів.
рН використовують не тільки для хімічних розрахунків, тому що це дуже важлива характеристика розчину. Так, в залежності від значення рН змінюється напрямок хімічних реакцій. Наприклад, при реакції калій перманганату з натрій сульфатом (IV), в залежності від рН середовища можуть утворюватись такі продукти:
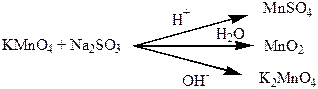
У аналітичній хімії застосовують визначення рН у кількісному аналізі, цей метод так і називається рН -метрія. У медицині за допомогою визначення рН крові, шлункового соку, сечі діагностують багато захворювань. У сільському господарстві вимірюють рН середовища, для того щоб вносити ті чи інші добрива: у лужні ґрунти вносять подвійний суперфосфат, у кислі – кісткову муку. рН дуже важливий показник для косметології, одна з важливих характеристик кремів та шампунів – це рН.
Таким чином можна сказати, що хоча дисоціація води дуже слабка, вона має велике значення у природі та у діяльності людини.
рН середовища точно вимірюють за допомогою рН -метрів, а швидко та лише характер – за допомогою індикаторів.
Індикатори – це слабкі електроліти органічного походження, у яких йони та молекули мають різне забарвлення.
Наприклад, фенолфталеїн у лужному середовищі має червоно-малиновий колір, а у нейтральному та кислому – безбарвний.
Це слабка кислота. Позначимо органічну частину молекули Ind, тоді механізм його дії:
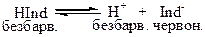
У кислому середовищі (при надлишку Н+) рівновага зміщується вліво – розчин безбарвний. У лужному середовищі (надлишоу ОН-) йони Н+ зв’язуються з йонами ОН-:
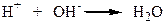
Цей процес зміщує рівновагу вправо – розчин червоний.
Індикаторів багато у природі. Наприклад, сік вишні, шовковиці темно червоний у нейтральному середовищі та синій у присутності мила (лужне середовище); від характеру середовища ґрунтів залежить колір деяких квітів.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1285; Нарушение авторских прав?; Мы поможем в написании вашей работы!