
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон еквівалентів
|
|
|
|
Поняття еквівалент має хімічне походження, але широко використовується у різних галузях науки та повсякденному житті. Воно використовується для позначення яких-небудь взаємозамінних величин. Так вартість будь-якого продукту пропорційна кількості витраченої на його виготовлення праці. Ілюстрацією закону еквівалентів є курс валют.
Хімічний еквівалент – частина атома, молекули або йона, яка припадає на одиницю валентності. По аналогії з відносною атомною масою та молярною масою розглядають відносну еквівалентну масу та молярну масу еквівалента з тими ж одиницями вимірювання:

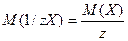 (г/моль), де
(г/моль), де
z – число еквівалентності.
Число еквівалентності у кислот дорівнює числу атомів Гідрогену, у основ – числу гідроксидних груп, у солей – сумарній валентності металу, у оксидів – сумарній валентності металу і Оксигену. Наприклад:
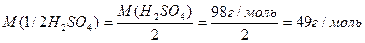


 Такі обрахунки значень молярних мас еквівалентів можна вважати як формульними значеннями. Вони показують співвідношення мас елементів при утворенні вказаних молекул. Ці значення можуть відрізнятися при хімічній взаємодії речовин як в реакціях обміну, так і в окисно-відновних реакціях.
Такі обрахунки значень молярних мас еквівалентів можна вважати як формульними значеннями. Вони показують співвідношення мас елементів при утворенні вказаних молекул. Ці значення можуть відрізнятися при хімічній взаємодії речовин як в реакціях обміну, так і в окисно-відновних реакціях.
Реакції обміну – значеня молярної маси еквівалента кислоти, основи або солі може залежати від кількості частинок (функціональних груп), які обмінюються при реакції. Наприклад, формульне значення молярної маси еквівалента ортофосфатної кислоти:

Розглянемо реакцію нейтралізації (обміну):
1. NaOH + H3PO4 = NaH2PO4 + H2O 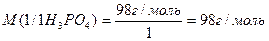
2. 2NaOH + H3PO4 = Na2HPO4 + 2H2O 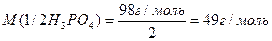
3. 3NaOH + H3PO4 = Na3PO4 + 3H2O 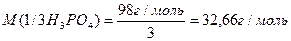
Отже числове значення молярної маси еквівалента речовин залежить від співвідношення вихідних речовин та продуктів, які утворюються.
При розрахунках за окисно-відновними реакціями число еквівалентності (z) дорівнює числу відданих чи приєднаних електронів.
Закон еквівалентів – речовини взаємодіють між собою у еквівалентних (тобто рівних) співвідношеннях, або маси речовин, які приймають участь у реакціях, відносяться між собою, як молярні маси їх еквівалентів.
А + 2В → АВ2
m(A): m(B): m(AB2) = M(1/zA): M(1/zB): M(1/zAB2)
Застосування закону еквівалентів суттєво спрощує розрахунки за хімічними рівняннями. При цьому важливий висновок із закону еквівалентів: з одним еквівалентом однієї речовини або елемента взаємодіє тільки один еквівалент іншої речовини або елементу. Цей закон був сформульований Ріхтером.
Хімічні речовини можуть існувати у чотирьох агрегатних станах: твердому, рідкому, газоподібному та плазмі. Агрегатний стан залежить від сили взаємодії молекул між собою. Для описання газоподібного агрегатного стану використовують закон Авогадро.
Закон Авогадро – у рівних об’ємах різних газів за однакових умов (температура та тиск) знаходиться однакова кількість молекул. Закон Авогадро виконується лише для газоподібних речовин. Це пояснюється особливостями цього стану речовин.
Висновок з закону Авогадро: молярний об’єм різних газів за нормальних умов (н.у.) величина постійна – 22,4 дм3/моль (22,4 л/моль) (н.у.: Т = 273 К, р = 101,3 кПа).
Густина твердих та рідких речовин (ρ, г/см3) – таблична величина. На відміну від них густина газів вимірюється в г/дм3 (г/л) та може бути розрахована за молярною масою та молярним об’ємом:

Для газів використовують також поняття відносної густини – відношення маси певного об’єму газу до маси такого ж об’єму іншого газу:
 Це безрозмірна величина.
Це безрозмірна величина.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 385; Нарушение авторских прав?; Мы поможем в написании вашей работы!