
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основи кінетики та енергетики хімічних процесів
|
|
|
|
Швидкість хімічних реакцій
Хімічні реакції проходять з різними швидкостями. Швидкість реакції вимірюється зміною концентрації реагуючих речовин за одиницю часу (моль/дм3). Швидкість реакцій залежить від багатьох факторів: природи реагуючих речовин, концентрації, температури, поверхні розділу фаз, каталізаторів.
Швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин у ступенях, які дорівнюють стехіометричним коефіцієнтам у рівнянні реакції (закон діючих мас):
mА + nВ → рС
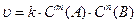 , де
, де
k – константа швидкості реакції.
Константа швидкості реакції твердих речовин не залежить від концентрації реагуючих речовин, але залежить від природи речовин, температури та площі поверхні реагуючих речовин.
Фізичний зміст константи швидкості – вона дорівнює швидкості реакції при концентраціях реагуючих речовин рівних одиниці.
Вплив температури на швидкість реакції
З підвищенням температури збільшується доля активних молекул в системі, тобто збільшується кількість зіткнень активних молекул з утворенням молекул продуктів реакції.
Підвищення температури на кожні десять градусів супроводжується підвищенням швидкості у 2-4 рази (це γ – коефіцієнт Вант-Гоффа).
Вплив каталізаторів на швидкість реакції
Існує ряд речовин, які можуть впливати на швидкість реакції, не входячи при цьому до складу її продуктів. Це каталізатори, а їх дія на швидкість має назву каталіз. Каталіз може бути прискорюючим або уповільнюючим. Уповільнюючі каталізатори ще називають інгібіторами. Для промисловості важливо мати як прискорюючі каталізатори, так і інгібітори. Дія каталізаторів пояснюється їх впливом на енергію активації (Еа). Еа – це той запас енергії, який повинна мати частинка (молекула, атом, йон), щоб відбулася реакція.
Хімічна рівновага
Всі хімічні реакції можна поділити на оборотні та необоротні. Необоротні реакції відбуваються в одному напрямку, тобто від вихідних речовин до продуктів реакції. Оборотні проходять з достатньо великою швидкістю в прямому та зворотному напрямку. Більшість реакцій є оборотними, абсолютно необоротних реакцій не існує. Прикладом оборотної реакції є синтез амоніаку:
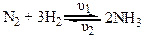
У випадку оборотного процесу швидкість прямої реакції за законом діючих мас можна виразити рівнянням:
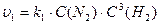
Швидкість зворотної реакції виражається рівнянням:
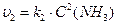
При встановленні хімічної рівноваги швидкості прямої та зворотної реакцій однакові:
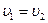
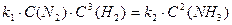
звідси:
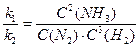
Замінюючи співвідношення 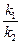 сталою К, отримуємо:
сталою К, отримуємо:

Рівновага встановлюється за умови, коли відношення добутку концентрацій продуктів реакції до добутку концентрацій вихідних речовин дорівнює деякій сталій величині – константі рівноваги. Константа рівноваги визначається природою реагуючих речовин, її величина не залежить від концентрації, але залежить від температури. При підвищенні температури константа рівноваги зростає, якщо швидкість прямої реакції збільшується швидше, ніж зворотної.
Значення константи рівноваги використовують технологи при проведенні промислових процесів. Якщо значення константи рівноваги за певних умов значно більше за одиницю, такі параметри сприяють одержанню цільового продукту.
Зміщення хімічної рівноваги відбувається відповідно правилу (принципу) Ле Шател’є: якщо на систему, що знаходиться у стані рівноваги, відбувається будь – яка зовнішня дія (змінюється концентрація, температура,тиск), то ця дія сприяє протіканню тієї реакції, яка зменшує вплив на систему.
Рівноважні процеси широко застосовуються в хімічній промисловості для регулювання швидкості процесів. Наприклад, в процесі одержання гідроген хлориду використовують підвищення концентрації водню для прискорення процесу, а також для більш повного використання хлору.
Основи енергетики хімічних процесів
Енергія – це абстрактне поняття для визначення здатності системи до виконання роботи або переносу теплоти.
Ще одне визначення енергії – це загальна міра різних форм руху матерії. Енергія може передаватись від однієї системи до іншої у формі теплоти або роботи.
Теплота та робота – це форми передачі енергії, у цьому їх спільність. Але вони мають свої особливі властивості.
Теплота – це передача енергії від однієї системи до іншої шляхом теплопровідності або випромінювання за рахунок зміни швидкості хаотичного руху мікрочастинок системи.
Робота – це направлене переміщення сукупності мікрочастинок (а це вже макрочастинка) під дією зовнішньої сили.
Для хімії важливим є поняття хімічна енергія. Прийнято вважати хімічною енергією енергію хімічних зв’язків. Також відомо, що носієм хімічної енергії є електрон. При утворенні хімічного зв’язку відбувається відрив, або відтягування електрона від одного атома та приєднання електрона до іншого атома.
Хімічна енергія – це енергія, яка випромінюється (Е1) при приєднанні електрона до позитивно зарядженого йону чи атома (Cl0 +  → Cl-), або поглинається (Е2) при відриві електрона від атома. Характерно, що електрон рухається при цьому у полі ядра атома, якому належить електрон, або переходить під вплив ядра другого атома, до якого він переходить при окисно-відновних процесах. Тобто хімічну енергію можна назвати енергією внутрішньомолекулярної взаємодії атомів. Або енергія хімічного зв’язку – це різниця між Е1 та Е2.
→ Cl-), або поглинається (Е2) при відриві електрона від атома. Характерно, що електрон рухається при цьому у полі ядра атома, якому належить електрон, або переходить під вплив ядра другого атома, до якого він переходить при окисно-відновних процесах. Тобто хімічну енергію можна назвати енергією внутрішньомолекулярної взаємодії атомів. Або енергія хімічного зв’язку – це різниця між Е1 та Е2.
Перебіг хімічних реакцій супроводжується енергетичними ефектами. За характером енергетичних ефектів хімічні реакції поділяються на екзотермічні (проходять з виділенням енергії) та ендотермічні (проходять з поглинанням енергії). При утворенні будь-якого зв’язку енергія випромінюється, а енергетичний ефект реакції може бути як екзо- так і ендотермічним. Це пояснюється тим, що при перебігу реакції відбувається не лише утворення нових зв’язків (Е1), але і руйнування існуючих у вихідних речовинах (Е2).
Мірою енергії, яка накопичується речовиною при її утворенні є ентальпія Н. У залежності від співвідношення ентальпії кінцевих продуктів реакції (Нкін.) та ентальпії вихідних реагуючих речовин (Нвих.):
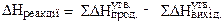
розрізняють екзо- та ендотермічні процеси. Якщо енергія, яка витрачена на розрив зв’язків у вихідних речовинах, менша за енергію, яка випромінюється при утворенні зв’язків у продуктах реакції, – процес екзотермічний (ΔН < 0) і спостерігається підвищення температури:
H2 + Cl2 = 2HCl, ΔH = -184,6 кДж
У випадку ендотермічного процесу (ΔН > 0) температура системи знижується або реакція відбувається при високих температурах – це означає, що на розрив зв’язків у вихідних речовинах витрачено частину кінетичної енергії молекул навколишнього середовища. Наприклад:
N2 + O2 = 2NO, ΔH = 180,8 кДж
Ця реакція відбувається при t=3500 °С (температура вольтової дуги).
Кількість теплоти, що виділяється або поглинається під час реакції, називається тепловим ефектом реакції (ΔН). Хімічні рівняння, в яких наводяться теплові ефекти реакцій, називаються термохімічними.
Розділ термодинаміки, який висвітлює енергетичні ефекти певних процесів, називається термохімією і базується на законі Гесса.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 422; Нарушение авторских прав?; Мы поможем в написании вашей работы!