
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дихромат и хромат калия как окислители
|
|
|
|
| K2Cr2O7 (кислая и нейтральная среда), K2CrO4 (щелочная среда) + восстановители → всегда получается Cr+3 | ||
| кислая среда Cr2O72- + H+→ Cr3+ CrO42- + H+→ Cr3+ | нейтральная среда | щелочная среда |
| Соли тех кислот, которые участвуют в реакции: CrCl3, Cr2(SO4)3 | Cr(OH)3 | K3[Cr(OH)6] в растворе, K3CrO3 или KCrO2 в расплаве |
| К2Сг2О7 + 3K2SО3 + 4H2SО4 → Cr2 (SО4)3 + 4K2SO4 + 4Н2О | 2K2CrO4 + 8H2O + 6KI → 2Cr(OH)3 +3I2 + 10KOH K2Cr2O7 + 3К2SO3 +4H2O→ 3К2SO4+ 2Cr(OH)3+2KOH | K2Cr2O7 + 2KOH →2K2CrO4 + H2O |
Схема 3. Поведение хрома +6 в ОВР

Приведем примеры:
K2Cr2O7 + К2SO3 + H2SO4®
Окислитель восстановитель создает кислую среду
Следовательно, дихромат превратится в сульфат хрома (III), сульфит окислится до сульфата, ионы калия свяжутся сульфат-ионами, ионы водорода превратятся в воду.
K2Cr2O7 + 3К2SO3 + 4H2SO4= 4К2SO4+ Cr2(SO4)3+ 4H2O
K2Cr2O7 + К2SO3 + H2O®
Окислитель восстановитель среда близка к нейтральной (слабо щелочная из-за гидролиза сульфита), следовательно дихромат превратится в гидроксид хрома (III), сульфит окислится до сульфата, ионы калия свяжутся с гидроксид-ионами.
K2Cr2O7 + 3К2SO3 + 4H2O = 3К2SO4+ 2Cr(OH)3+2KOH
K2CrO4 + К2SO3 + KOH ®
Окислитель восстановитель создает щелочную среду
Следовательно, хромат превратится в гексагидроксохромат (III) калия, сульфит окислится до сульфата, побочный продукт - вода, при расстановке коэффициентов оказывается, что воду нужно перенести в левую часть уравнения:
2K2CrO4 + 3К2SO3 + 2KOH + 5H2O = 3К2SO4+ 2K3[Cr(OH)6]
K2CrO4 + К2S + H2O ®
Окислитель восстановитель за счет гидролиза создает щелочную среду
Следовательно. хромат превратится в гексагидроксохромат (III) калия, сульфид окислится до серы, побочный продукт - вода:
2K2CrO4 + 3К2S + 8H2O = 3S+ 2K3[Cr(OH)6] + 4KOH
| Cr+3 (Cr(OH)3, соли) Cr+3 + очень сильные окислители → Cr+6 (всегда независимо от среды!) | |
| кислая среда | щелочная среда |
| образуется дихромат K2Cr2O7 или дихромовая кислота H2Cr2O7 | образуется хромат K2CrO4 |
| 2CrCl3 + HClO3 + 4H2O → H2Cr2O7 + 7HCl кислая среда | 2CrCl3 + 16NaOH + 3Br2 → 6NaBr + 6NaCl + 8H2O + 2Na2CrO4 Cr2(SO4)3 + 3Br2 + 16NaOH → 2Na2CrO4 + 6NaBr + 3Na2SO4 + 8H2O |
Соответственно, все соединения хрома (III) можно окислить в кислой среде до дихромата, в щелочной – до хромата.
Наример:
2Cr(OH)3 +3Cl2 + 10KOH = 2K2CrO4 + 6КCl + 8H2O
восстановитель окислитель щелочная среда продукт окисления
2CrCl3 + HClO3 + 4H2O = H2Cr2O7 + 7HCl
восстановитель окислитель кислая среда продукт окисления
АЗОТНАЯ КИСЛОТА В ОВР
Азотная кислота может окислять металлы, неметаллы, сложные вещества. При окислении неметаллов и сложных веществ концентрированная азотная кислота, как правило восстанавливается до оксида азота (IV), разбавленная – до оксида азота (II)
Схема 4. Поведение концентрированной азотной кислоты в ОВР

Cхема 5. Поведение разбавленной азотной кислоты в ОВР 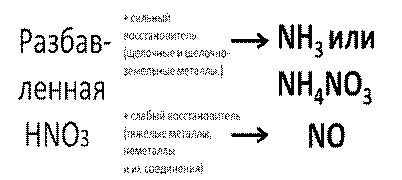
Особенно часто в ЕГЭ встречаются уравнения реакций окисления сульфидов азотной кислотой. Концентрированная азотная кислота окисляет соединения серы до сульфатов, разбавленная – окисляет сульфиды до свободной серы.
Рассмотрим примеры:
CuS + 8HNO3 (конц.) = Cu SO4 + 8 NO2 + 4H2O
3H2S + 2HNO3 (разб.) = 3 S + 2 NO + 4H2O
СЕРНАЯ КИСЛОТА
Схема 6. Поведение концентрированной серной кислоты в ОВР 
Приведем примеры:
H2SO4 + 2HBr = Br2 + SO2 + 2H2O (бромоводород – слабый восстановитель)
H2SO4 + 8HI = 4I2 + H2 S+ 4H2O (йододород – сильный восстановитель)
Галогены и их кислородные соединения восстанавливаются до галогенид-анионов:
KClO3 +3KNO2 = KCl + 3KNO3
Ферраты восстанавливаются до солей железа (III):
2K2FeO4 + 16HCl = 3Cl2 + 2FeCl3 + 4KCl + 8H2O
Наиболее часто встречающиеся в ЕГЭ восстановители: сероводород, сульфиды, сульфиты, нитриты, галогениды, аммиак, невысшие оксиды (марганца, фосфора, серы), соли железа (II), марганца (II), хрома (II) и (III), металлы.
Наибольшее разнообразие продуктов дают соединения серы:
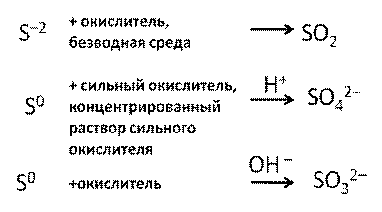 Схема 7. Окисление соединений серы
Схема 7. Окисление соединений серы
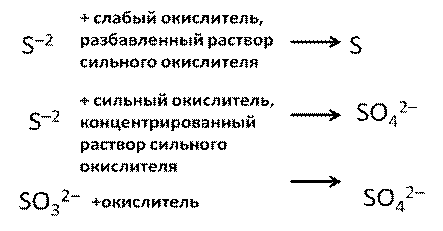
С остальными восстановителями всё достаточно однозначно:
Нитриты окисляются до нитратов, галогениды окисляются до свободных галогенов (в случае очень сильных окислителей – до галогенат-анионов ГалО3 –).
Аммиак окисляется, как правило, до азота.
Невысшие оксиды фосфора и серы в безводной среде – до высших оксидов, в нейтральной и кислой среде – до высших кислот, в щелочной среде – до солей высших кислот.
Оксид марганца (IV) – до манганата в щелочной среде, перманганата – в кислой среде.
Соли железа (II) – до солей железа (III) в кислой среде, до гидроксида железа (III) – в нейтральной и щелочной среде, очень сильные окислители в щелочной среде приводят к окислению до феррата.
Соли марганца (II) – в нейтральной среде до оксид марганца (IV), в щелочной среде – до манганата, в кислой в присутствии очень сильного окислителя – до перманганата.
Соли хрома (II) окисляются до солей хрома (III), соли хрома (III) - в щелочной среде до хроматов, в кислой – до дихроматов.
ЗАДАНИЕ
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 15686; Нарушение авторских прав?; Мы поможем в написании вашей работы!