
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы окислительно-восстановительных реакций
|
|
|
|
Все химические реакции, в которых электроны переходят от одного вещества или его части (восстановителя) к другому веществу или к другой части одного и того же вещества (окислителю), называются окислительно-восстановительными, или редокспроцессами. Любому веществу-окислителю (ox1) соответствует восстановленная форма (red1), а восстановителю (red2) – окисленная форма (ox2), вместе они образуют сопряженную окислительно-восстановительную пару (полуреакцию):

|

|
Сложение обеих полуреакций позволяет записать в общем виде окислительно-восстановительную реакцию:
|
Если передача электронов от восстановителя к окислителю происходит во всем объеме раствора, то энергия химического взаимодействия рассеивается в окружающую среду в виде тепла (Δ H < 0).
В зависимости от того, находятся ли атомы, выполняющие в реакции функцию окислителя (акцептора электронов) и восстановителя (донора электронов) в одном или в различных веществах, все окислительно-восстановительные процессы можно разделить на три типа: межмолекулярные, внутримолекулярные и диспропорционирования.
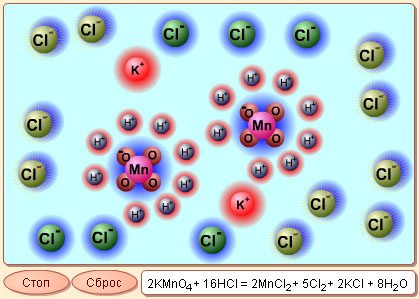
| |||
Модель 7.1. Окислительно-восстановительные реакции.
В этой модели продемонстрированы процессы, происходящие в сложной окислительно-восстановительной реакции взаимодействия KMnO4 с HCl. Запустив эту модель кнопкой «Старт», вы можете просмотреть весь процесс реакции с начала до конца. Однако лучше всего останавливать процесс кнопкой «Стоп» по окончании какой-либо его стадии, чтобы внимательно проследить все произошедшие изменения. Используйте кнопку «Сброс», если хотите вернуть модель к начальному состоянию. Первой стадией, которую проходит процесс реакции, является разделение молекул соляной кислоты и перманганата калия на ионы за счет гидратации. Затем часть ионов хлора и ионы марганца отдают электроны, которые затем переходят к атомам кислорода, восстанавливая их до O2–. После этого ионы кислорода соединяются с ионами водорода с образованием воды. Оставшиеся ионы Mn2+, Cl– и К+ и в реальности будут пребывать в растворе в гидратированном виде. В целях демонстрации того, как принято записывать продукты произошедшей реакции, эти ионы объединены в следующей стадии в MnCl2 и KCl. Результирующее уравнение реакции выглядит так:
Алгоритм расстановки коэффициентов в этой и подобных реакциях вы можете узнать в описании к модели «Стехиометрические коэффициенты».
|
В межмолекулярных (межатомных) реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например, в реакции H2S + Cl2 = S + 2HCl электроны от восстановителя – молекулы сероводорода – переходят к окислителю – молекуле Cl2.
В реакциях внутримолекулярного окисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества:

|

|

|
| Модель 7.2. Вытеснение водорода металлом. В данной модели схематически показан процесс реакции лития с водой на молекулярном уровне. В процессе реакции два атома водорода отщепляются от двух молекул воды и, соединившись в молекулу водорода, покидают объем, в котором идет реакция, в составе газовых (водородных) пузырьков. При этом образуется гидроксид лития, который в воде распадается на ионы Li+ и ОН–. Сама реакция может протекать весьма зрелищно. Литий легче воды, поэтому он плавает на ее поверхности. Образующиеся пузырьки водорода толкают его в разные стороны. Если выделяющийся водород поджечь, то мы увидим бегающий по поверхности воды огонек. Щелочные элементы (к которым относится литий) способны образовывать оксиды Э2О. Также они могут образовывать и пероксиды Э2О2. Последние способны взаимодействовать с СО2 воздуха, будучи заключенными в контейнер, через который этот воздух прокачивается. При этом образуется кислород О2 в реакции 2 Э2О2 + 2 СО2 = 2 Э2СО3 + О2. Этот процесс используется в космических станциях для регенерации воздуха. |
Реакции диспропорционирования (самоокисления-самовосстановления) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Они характерны для соединений или простых веществ, состоящих из промежуточных степеней окисления данного элемента:

|

|

|

|
| Модель 7.3. Металлы в кислой и щелочной среде. Эта модель демонстрирует взаимодействие активных металлов с сильными кислотами и основаниями. Вы можете поместить в большую колбу любые два реагента из пробирок (для этого нужно перетащить рисунок, изображающий соответствующую пробирку, на занимаемое колбой пространство и отпустить его там). Для последующих экспериментов колбу необходимо опорожнить, перетащив ее на схематическое изображение бака для отходов. Можно увидеть, что активный металл, который в электрохимическом ряду напряжений расположен слева от водорода (в данном случае взят магний), реагирует с кислотой, однако не дает никакой реакции с основанием. Вы можете проверить кислотность раствора, находящегося в колбе, добавив туда лакмус. Красный цвет говорит о наличии кислоты, синий – о наличии щелочи. |
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 658; Нарушение авторских прав?; Мы поможем в написании вашей работы!
