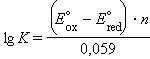КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Конструирование гальванического элемента
|
|
|
|
Лабораторная работа №8.
Цель:
1. Записать гальванический элемент.
2. Записать электронную и суммарную реакцию.
3. Вычислить ЭДС.
|
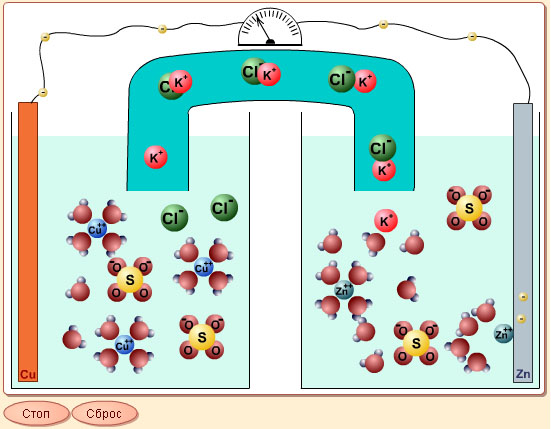
| Модель 7.5. Гальванический элемент. Эта анимация демонстрирует перевод окислительно-восстановительных реакций в режим химического источника тока. Рассмотрите внимательно, например, судьбу атома цинка, первоначально являвшегося частью цинкового электрода. Атом отдает два электрона и переходит в раствор. Электроны уходят с цинкового электрода по проводам, снимая тем самым с него отрицательный заряд, который мог бы препятствовать дальнейшему растворению электрода. Электроны попадают на медный электрод, куда подходит ион меди и, получив два электрона, оседает уже в качестве нейтрального атома на медном электроде. Тем временем должно быть восстановлено равновесие заряда – электроны попали из одной части гальванического элемента в другую. Поэтому в правой части модели (со стороны цинкового электрода) при уходе двух электронов по внешней цепи от цинка к меди в солевой мостик (проводник второго рода) уходят два иона калия либо из него выходят два иона хлора. В любом случае восстанавливается электронейтральность стакана с цинковым электродом. Аналогично при переходе электронов на медный электрод из солевого мостика выходят ионы калия, либо туда входят ионы хлора. Обратите внимание, что солевой мостик (иногда его функция отводится пористой перегородке), разделяя анодное и катодное пространства гальванического элемента, исключает протекание окислительно-восстановительной реакции Zn + Cu2+ = Zn2+ + Cu в тепловом варианте, обеспечивает замыкание цепи, заставляя электроны переходить от анода (цинк) к катоду (медь) по внешней цепи (проводник первого рода), выделяя энергию на нагрузке. В случае, когда внешняя цепь разомкнута, напряжение между электродами (разность потенциалов) равно ЭДС гальванического элемента. |
Итак, сопоставляя электродные потенциалы соответствующих систем, можно заранее определить направление, в котором будет протекать окислительно-восстановительная реакция при любых (нестандартных) условиях. Окисленная форма вещества с более высоким потенциалом является окислителем для восстановленных форм с более низким потенциалом.
Однако в большинстве случаев о направлении реакции можно судить по разности стандартных электродных потенциалов 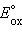 –
– 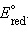 В случае, когда эта разность близка к нулю, для определения направления реакции используют разность не стандартных, а реальных (с учетом активности ионов) потенциалов, вычисленных по уравнению Нернста.
В случае, когда эта разность близка к нулю, для определения направления реакции используют разность не стандартных, а реальных (с учетом активности ионов) потенциалов, вычисленных по уравнению Нернста.
Равновесное состояние любой окислительно-восстановительной реакции характеризуется нулевой ЭДС (Δ G равн = 0). Тогда из уравнения (7.3) следует
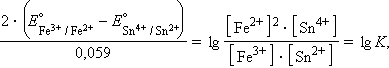
|
то есть представляется возможность определить константу равновесия из электрохимических данных.
При
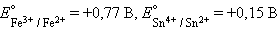
|
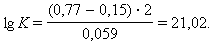
|
Следовательно, реакция 2Fe3+ + Sn2+ = 2Fe2+ + Sn4+ будет самопроизвольно протекать слева направо, поскольку константа равновесия ее очень велика (K = 1 · 1021).
В общем виде связь ЭДС с K выражается уравнением
|
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 630; Нарушение авторских прав?; Мы поможем в написании вашей работы!