
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные реакции с участием органических веществ
|
|
|
|
Реакции самоокисления-самовосстановления
Различают 2 основных типа окислительно-восстановительных реакций:
- межмолекулярные, в которых атомы окислителя и восстановителя находятся в со-
ставе разных частиц;
- внутримолекулярные, в которых атомы окислителя и восстановителя находятся в
одной частице.
Существует большая группа окислительно-восстановительных процессов, в которых окислителями и восстановителями являются атомы одного и того же элемента. Такие реакции называются реакциями самоокисления-самовосстановления или реакциями диспропорционирования.
Различают два вида таких процессов. Один из них – это дисмутация, при которой элемент из одной степени окисления переходит в две новых, меньшую и большую относительно исходной. Эти процессы чаще протекают в щелочной, реже в нейтральной среде.
Примером может служить уже описанная реакция хлора с растворами щелочей. Интересный пример - это реакция диоксида азота с щелочами:
+4 +3 +5
NO2 + 2 KOH = KNO2 + KNO3 + H2O
Реакции дисмутации могут быть и внутримолекулярыми:
+5 t -1 +7
KClO3 = KCl + KClO4
Второй вид процессов - это конмутация. В ходе этих процессов атомы одного и того же элемента из разных степеней окисления сходятся к одной, промежуточной между исходными. Реакции конмутации протекают, как правило, в кислотной, реже в нейтральной среде.
+5 -1 0
K C lO3 + 6H C l = KCl +3Cl2 + 3H2O
ок-ль в-ль
Интересна реакции диоксида серы с сероводородом, используемая в промышленности:
+4 -2 0
S O2 + 2H2 S = 3S +2 H2O
ок-ль в-ль
Конечная степень окисления не обязательно будет нулевой. Вот еще пример:
+7 +2 +4
2KMnO4 + 3MnSO4 +2H2O = 5MnO2 + K2SO4 + 2H2SO4
Для нахождения коэффициентов в ОВР с участием органических веществ различных классов удобно использовать метод электронно-ионного баланса. В данных реакциях органические вещества почти всегда являются восстановителями. Естественно, необходимо знать, какими будут продукты окисления органических веществ.
Рассмотрим реакцию Вагнера - окисление алкенов перманганатом калия в холодных нейтральных растворах. В качестве восстановителя возьмем пропен C3H6. Запишем схему реакции:
C3H6 + KMnO4 + H2O = C3H6(OH)2 +MnO2 + KOH
Составим уравнения полуреакций:
 MnO4- + 2 Н2О + 3е- → MnO2 + 4ОН- 2
MnO4- + 2 Н2О + 3е- → MnO2 + 4ОН- 2
C3H6 + 2 Н2О - 2e- → C3H6(OH)2 + 2 H+ 3
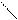 2MnO4- + 10 Н2О + 3 C3H6 → MnO2 + 8 ОН- + 6 H+ + 3C3H6(OH)2
2MnO4- + 10 Н2О + 3 C3H6 → MnO2 + 8 ОН- + 6 H+ + 3C3H6(OH)2
4 6 Н2О + 2 ОН-
Сокращая воду в левой и правой частям, получаем окончательные коэффициенты:
3C3H6 +2 KMnO4 + 4H2O = 3C3H6(OH)2 + 2MnO2 + 2KOH
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 705; Нарушение авторских прав?; Мы поможем в написании вашей работы!