
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Связью
В зависимости от вида перекрывающихся облаков может образоваться s-s,
s-p, p-p, s-d, p-d σ-связи.
2. Боковое перекрывание:

В этом случае две области перекрывания электронных облаков находятся по разные стороны от плоскости, в которой лежат ядра связываемых атомов. Связь, образованная при таком перекрывании ЭО, называется π- связью.
Как и в случае σ-связи, в зависимости от вида перекрывающихся облаков могут образоваться различные разновидности π-связи: p-p, p-d, d-d π-связи.
π-связь –ковалентная связь между атомами образованная при боковом перекрывании их электронных облаков.
В методе валентных связей различают обменный и донорно-акцепторный механизмы образования химической связи.
Обменный механизм. К обменному механизму образования химической связи относятся случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону.
В молекулах Н2, Li2, F2 и Cl2 связи образуются за счет неспаренных s-электронов этих атомов. В молекулах HF и HCl связи образуются s-электронами водорода и p-электронами галогенов. Особенностью образования соединений по обменному механизму является насыщаемость, которая показывает, что атом образует не любое, а ограниченное количество связей. Их число, в частности, зависит от количества неспаренных валентных электронов.
Из квантовых ячеек N и Н можно видеть,
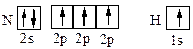
что атом азота имеет 3 неспаренных электрона, а атом водорода – один. Принцип насыщаемости указывает на то, что устойчивым соединением должен быть NH3, а не NH2, NH или NH4.
Донорно-акцепторный механизм – образование ковалентной связи за счёт двухэлектронного облака одного атома(донор) и свободной орбитали другого(акцептор).
Примером образования химической связи по донорно-акцепторному механизму является
реакция аммиака с ионом водорода: H+ + ׃NH3 = NH4+
Роль акцептора электронной пары играет пустая орбиталь иона водорода. В ионе аммония NH4+ атом азота четырехвалентен.
В молекуле аммиака заселены все четыре орбитали азота, из них три – по обменному механизму электронами азота и водорода, а одна содержит электронную пару, оба электрона которой принадлежат азоту. Такая электронная пара называется неподеленной электронной парой.
Донорно-акцeпторная связь отличается только способом образования; по свойствам она одинакова с остальными ковалентными связями.

В приведенных формулах нитросоединения связи азота с кислородом неравноценны. Однако, как показывают результаты физических исследований, эти связи энергетически совершенно одинаковы. Следовательно, электронная пара, обусловливающая отрицательный заряд, не сосредоточена целиком на каком-либо одном кислородном атоме, а несколько смещена к азоту при одновременном смещении от азота ко второму кислородному атому подвижной π-электронной пары двойной связи. В результате выравнивания электронной плотности в нитрогруппе формальный отрицательный заряд (-1) распределяется поровну (-1/2) между обоими атомами кислорода:

В плоском треугольном ионе (NO3)- делокализованные π-связи равномерно распределяются между всеми атомами кислорода. Точно также делокализованные π-связи равномерно распределяются между всеми атомами кислорода в соединениях (BO3)3-,(CO3)2-,SO3, в BF3 – между всеми атомами фтора,в анионах (PO4)3- и (SO4)2-, имеющих тетраэдрическое строение делокализованные связи равномерно распределяются между всеми атомами кислорода
(рис.2)
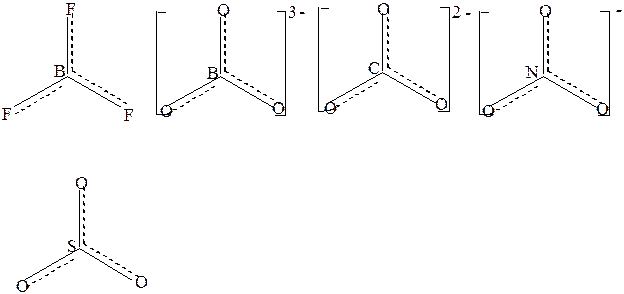

Рис.2 Структурные формулы некоторых с соединений с учётом делокализации π-связи.
|
|
Дата добавления: 2014-12-27; Просмотров: 472; Нарушение авторских прав?; Мы поможем в написании вашей работы!