
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Прочность увеличивается с уменьшением длины связи
|
|
|
|
При переходе от одинарной связи двойной и тройной (между одними и теми же атомами) энергия связи возрастает, однако связь укрепляется непропорцианально увеличению её кратности.
КДж/моль. В молекуле метана имеются четыре равноценные связи С-Н поэтому средняя энергия такой связи равна
Для двухатомных молекул энергия связи равна энергии диссоциации. Для многоатомных молекул с одним типом связи средняя энергия связи равна 1/n части распада молекулы на атомы. Энергия распада метана на атомы равна
Энергия связи
Важное значение имеет энергетическая характеристика химической связи. При образовании химической связи общая энергия системы (молекулы) меньше энергии составных частей (атомов), т.е. Е(AB)<Е(А)+Е(B).
Энергия связи – это энергия, которая выделяется при образовании молекулы из атомов. Энергию связи обычно выражают в кДж/моль (или ккал/моль). Это одна из важнейших характеристик химической связи. Более устойчива та система, которая содержит меньше энергии. Известно, например, что атомы водорода стремятся объединиться в молекулу. Это означает, что система, состоящая из молекул Н2 содержит меньше энергии, чем система, состоящая из такого же числа атомов Н, но не объединенных в молекулы.
Ес-н = 1649/4 = 412 кДж/моль. При последовательном отрыве атомов водорода меняется ядерная и электронная конфигурация системы и следовательно изменение энергии взаимодействия атомов, входящих в молекулу. Так, последовательный отрыв водорода от метана связан с затратой энергии равной соответственно 427, 368, 519 и
335 кДж/моль. Однако для любого вещества среднее арифметическое значение энергии отрыва совпадает со средней энергией связи. Ес-н = (427 + 368 + 519 +335)/4 = 412 кДж/моль.
Таблица 5 Длина и энергия разрыва связей
| d пм | E кДж/моль | d пм | E кДж/моль | ||
| C-H | C=O | ||||
| C-F | O-H | ||||
| C-Cl | O-O | ||||
| C-Br | S-H | ||||
| C-I | N-H | ||||
| C-C | As-H | ||||
| C=C | |||||
| C≡C |
Таблица 5 показывает:а)закономерное изменение энергии для однотипных связей(C-F>C-Cl>C-Br>C-I),
б)что длина связи уменьшается с возрастанием порядка или кратности связи, а
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Химическая связь в твердых телах. Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними.
Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов). Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl tпл. = 801 °C, а для NaNO3 tпл = 306,5 °C.

Пример 1. Каким типом гибридизации АО бериллия описывается образование молекулы хлорида бериллия? Какова конфигурация этой молекулы?
Решение:
Возбужденный атом бериллия имеет конфигурацию 2s12p1. Поэтому можно считать, что в образовании химических связей могут участвовать не одинаковые, а различные атомные орбитали. В молекуле BeCl2 должны быть неравноценные по прочности и направлению связи, причем σ-связи из p-орбиталей должны быть более прочными, чем связи из s-орбиталей, т.к. для p-орбиталей имеются более благоприятные условия для перекрывания. Однако опыт показывает, что в молекулах, содержащих центральные атомы с различными валентными орбиталями (s, p, d), все связи равноценны – это объясняет метод гибридизации. В данном случае имеет место sp- гибридизация
При образовании молекулы одна s- и одна р-орбиталь образуют две гибридные sp-орбитали под углом 180о.
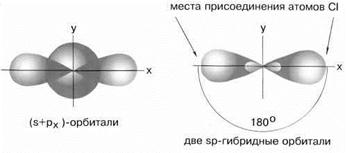
sp-гибридные орбитали
Экспериментальные данные показывают, что все галогениды Be, а также Zn, Cd и Hg (II) линейны и обе связи имеют одинаковую длину.
Пример 2. Определите тип гибридизации орбиталей центрального атома в молекуле BF3. Какова конфигурация этой молекулы?
Решение:
Возбуждённый атом бора имеет конфигурацию 2s12p2.
В результате гибридизации одной s-орбитали и двух p-орбиталей образуются три гибридные sp2-орбитали, расположенные в одной плоскости под углом 120о друг к другу.

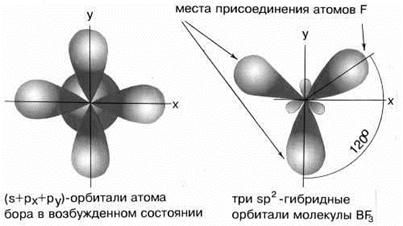
sp2-гибридизация
Пример 3. Каким типом гибридизации АО азота описывается образование молекулы аммиака?
Решение:
В результате гибридизации 2s и трёх 2p орбиталей азота образуются четыре гибридные орбитали sp 3 . Конфигурация молекулы представляет из себя искажённый тетраэдр, в котором три гибридных орбитали участвуют в образовании химической связи, а четвёртая с парой электронов – нет. Углы между связями N-H не равны 90 о как в пирамиде, но и не равны 109,5 о , соответствующие тетраэдру.

sp3- гибридизация в молекуле аммиака
При взаимодействии аммиака с ионом водорода в результате донорно-акцепторного взаимодействия образуется ион аммония, конфигурация которого представляет собой тетраэдр.
Пример 4. Объяснить с позиций метода МО возможность существования молекулярного иона Не2+
Решение:
В молекулярном ионе Не2 + имеется три электрона.На связывающей орбитали размещены два электрона,а на разрыхляющей –один. Следовательно кратность связи равна 0, и он должен быть энергетически устойчивым.
Пример 5. Определите энергию связи кислород-водород в молекуле Н2О если энергия связи Н-Н и О-О соответственно равны 4359 и -4987 кДж/моль а при сгорании 2 моль кислорода выделяется 48368 кДж теплоты.
Решение:
Процесс образования молекулы воды можно представить следующим образом: рвутмя связи водород-водород и кислород-кислород а образовавшиеся аиомы соединяются в молекулы Н2О каждая из которых содержит две связи кислород-водород:
4Н(г) = 2Н2(г) – 435,9∙2
2О(г) = О2(г) – 498,7
2Н2(г) + О2(г) = 2Н2О(г) - 483,68
----------------------------------------------------
4Н(г) + 2О(г) = 2Н2О(г) - 1854,18 кДж
В двух молекулах Н2О четыре связи кислород-водород; средняя энергия связи кислород – водород равна: -1854,18 / 4 = - 463,54 кДж/моль
1. Напишите электронные формулы для атомов натрия,железа;для ионов Cr3+,C1-.Какие атомы или ионы изоэлектронны иону Cl-?
2. Как изменяется с ростом порядкового номера значение первого потенциала ионизации у элементов второго периода?
3. Пользуясь правилом Гунда, распределите электроны по орбиталям, отвечающим высшему энергетическому состоянию атомов фосфора и алюминия.
4. На каком основании Cr и S,C1 и Мп расположены в одной группе
периодической системы Д.И.Менделеева? Почему их помещают в разных подгруппах?
*5. Определите среднюю энергию связи 0-Н в молекуле воды, если энергия связей
0-0 и Н-Н соответственно равны (в кДж/моль):-498,7 и -435,9,а энтальпия сгорания водорода равна -241,8кДж/моль.
*6. Пользуясь таблицей относительных электроотрицательностей, определите,какая из связей является наиболее полярной:Са-Н, I-C1.C-S.
*7. В каком из приведенных соединений:LiF, BeF,BF,CF связь Э-F будет больше всего приближаться к ковалентной?
*8. Как изменяется прочность связи в ряду:НF-НСl-НВг-Н1?
*9. Каким типом гибридизации АО азота описывается образование молекулы NH3,иона NH4+?Какова пространственная структура этих частиц?
*10. Опишите с помощью метода МО электронное строение О2.Какими магнитными свойствами обладает молекула О2:диамагнитна или парамагнитна?
11. При переходе от NaF к Nal температура плавления кристаллов уменьшается. Объясните наблюдаемый ход изменения температур плавления.
*12. BaCl2 в водных растворах -сильный электролит,a HgCl2-слабый электролит. Объясните это различие в свойствах солей.
*13. Сероводород при обычной температуре - газ, а вода- жидкость. Чем можно объяснить это различие в свойствах?
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 2215; Нарушение авторских прав?; Мы поможем в написании вашей работы!