
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение комплексных соединений
|
|
|
|
По числу σ–связей, образуемых лигандом с комплексообразователем различают монодентатные, бидентатные, тридентатные,….полидендатные лиганды. Например,
в комплексном катионе [Cu(NH3)4]2+ каждый лиганд NH3 монодентатный, а в комплексном катионе [Cu(NH2CH2CH2NH2)2]2+ каждый лиганд NH2CH2CH2NH2 бидентатный.
Координационные соединения, в которых центральный атом (или ион) связан одновременно с двумя или более донорными атомами лиганда, в результате чего замыкается один или несколько гетероциклов, называются хелатами. Лиганды, образующие хелатные циклы, называются хелатирующими (хелатообразующими) реагентами. Замыкание хелатного цикла такими лигандами называется хелатированием (хелатообразованием). Наиболее обширный и важный класс хелатов – хелатные комплексы металлов.
Последний комплекс представляет собой хелат.
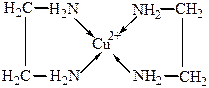
Для объяснения строения простых и комплексных частиц с центральными атомами d–элементов, имеющими незавершённый внутренний (n-1)d–подуровень, используют метод ВС, дополненный теорией кристаллического поля. В свободном атоме d–элемента подуровень (n-1)d пятикратно вырожден, т.е. все пять (n-1)d-АО имеют одинаковую энергию. Под воздействием электростатического поля лигандов энергия пяти (n-1)d-АО комплексообразователя дифференцируется и пятикратное вырождение снимается.
При октаэдрическом расположении лигандов вокруг центрального атома наибольшее отталкивание испытывают электроны, находящиеся на орбиталях dz2 и dx2-y2, направленных к лигандам, поэтому их энергия будет более высокой, чем у электронов, находящихся на орбиталях dxy,dxz,dyz, расположенных между лигандами. В октаэдрическом поле лигандов происходит расщепление d –уровня на два энергетических уровня: более высокий eg (соответствует орбиталям dz2,dx2-y2) и более низкий уровень t2g(соответствует орбиталям dxy,dxz,dyz).Таким образом, вырождение пяти d –орбиталей иона снимается частично, что приводит к образованию двукратно вырожденного уровня eg и трёхкратно вырожденного уровня t2g.
Разница в энергиях уровней eg и t2g называется энергией расщепления D.
Величина расщепления зависит от природы лиганда, что определяется положением лиганда в спектрохимическом ряду, определяемым экспериментально:
I- < Br- < SCN- < Cl- <NO3- < F- < OH- < ONO- < C2O42- < H2O < NCS- < CH3CN < NH3 < глицин < пиридин < этилендиамин< дипиридил < о-фенантролин < NC- < NO2- < CN- < CO.
Принято считать, что левее аммиака в спектрохимическом ряду располагаются лиганды “слабого поля”, а правее – лиганды “сильного поля”, дающие при прочих равных условиях большую величину расщепления.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 463; Нарушение авторских прав?; Мы поможем в написании вашей работы!