
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства буферных растворов
|
|
|
|
- Значение рН практически остаётся неизменным при разбавлении. И лишь при очень большом разбавлении (в 104 и более) значение рН может измениться на 0,5—1,0 единиц. Кроме того при точном измерении рН следует учитывать изменения коэффициентов активности кислоты и основания а они изменяются по-разному для заряженных и незаряженных электролитов.
- Буферные растворы мало изменяют рН при добавлении небольшого количества сильной кислоты или сильного основания.
- При равенстве концентраций буферной кислоты и буферного основания
С(буф.к-та) =С(буф.осн.) рН буферного раствора равно рКа рН=рКа.
Так экспериментально можно определить константу кислотности.
Механизм буферного действия — при добавлении небольшого количества сильной кислоты или сильного основания ионы Н3О+ и ОН- в эквивалентных количествах переходят в состав слабых электролитов(буферной кислоты или буферного основании).
Например:
К 1 л ацетатной буферной смеси в которой [СН3СООН] = [СН3СОО-] = 1 моль/л добавили 0,1моль HCl.
HCl + H2O = H3O+ + Cl- [H3O+] = [HCl] = 0,1 моль/л
рН исходной буферной смеси рН= рКа + lg[CH3COO-] / [CH3СOOH] = 4,76 + lg 1/1 = 4,76.
С кислотой взаимодействует буферное основание: СН3СОО- + Н3О+ = СН3СООН + Н2О
После добавления соляной кислоты [СН3СОО-] = 1,0 - 0,1 = 0,9(моль/л),
а [CH3COOH] = 1,0 + 0,1 = 1,1(моль/л).
Тогда рН буферной смеси после добавления соляной кислоты рН = 4,76 + lg 0,9 / 1,1 = 4,67.
рН буферной смеси уменьшилась на 4,76 – 4,67 = 0,09
В сравнении: при добавлении такого же количества хлороводорода в 1л воды рН = 1.
рН уменьшилась на 7-1 =6.
Каждый буферный раствор характеризуется сопротивляемостью к изменениям. Количественно её выражают буферной ёмкостью В, которая определяется числом моль эквивалентов кислоты или основания, которые необходимы для смещения рН 1л буферного раствора на одну единицу.
Обычно определяются буферная емкость по кислоте (Вк) и буферная емкость по щелочи (Вщ).
Вк = n(Н3О+)доб. / Vбуф.р-р ∙∆рН Вщ = n(ОН-)доб. / Vбуф.р-р ∙∆рН
Концентрация буферных компонентов определяет границы буферного действия и буферная ёмкость.
Пример 1. Рассчитайте рН раствора, приготовленного смешением 300мл 0,05М KH2PO4 и 200мл 0,1М Na2HPO4. pKa(H2PO4 -)= 7,2.
Решение:
рН буферного раствора равно: рН = рКа + lg 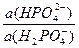
Определяем ионную силу раствора.
KH2PO4 = K+ +H2PO4- Na2HPO4 = 2Na+ + HPO42-
0,05 0,05 0,05 (моль) 0,1 0,2 0,1 (моль)
Объём буферного раствора: 300мл + 200мл = 500 мл =0,5л.
Концентрации ионов в буферном растворе равны:
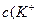 )=
)= 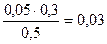 моль/л c(Na
моль/л c(Na  )=
)= 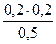 = 0,08моль/л
= 0,08моль/л
c(H2PO4-)= 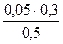 = 0,03 моль/л c(HPO42-)=
= 0,03 моль/л c(HPO42-)= 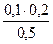 = 0.04 моль/л
= 0.04 моль/л
Ионная сила J= 0,5 (0,03·12 + 0,03·12 + 0,08·12 + 0,04·22)= 0,15.
По таблице находим коэффициенты активности f ионов. 

f(H2PO4-) =0,81. f(HPO42-) = 0,41.Рассчитываем рН данного буферного раствора:
pH= 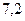 +lg
+lg 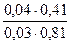 = 7,03.
= 7,03.
Пример 2 Какие объёмы 0,2М NH3·H2O и 0,1М NH4Cl необходимо взять для приготовления 200 мл буферного раствора с рН=9,54? pKb(NH3·H2O)=4,76. Ионная сила раствора J= 0,1.
Решение:
Коэффициент активности нейтральных молекул можно принять равными 1,
а f(NH4+) = 0,81 в соответствии с ионной силой.
pН данной буферной системы равно: рН = рКа(NH4+) + lg 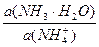
pKa(NH4+) = 14 – pKb = 14 – 4,76 = 9,24. pH = 9,24 + lg 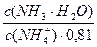
Предположим, что для приготовления буферного раствора взяли x (л) раствора аммиака. Тогда раствора хлорида аммония будет (0,2 – x)л.
c(NH3·H2O) = 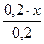 =x(моль/л) c(NH4+)=
=x(моль/л) c(NH4+)=  =(0,1-0,5x) моль/л.
=(0,1-0,5x) моль/л.
Подставляем полученные данные в уравнение для рН буферной системы:
9,54 = 9,24 + lg 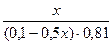 lg
lg 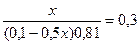
 x= 0,0895 (л) =89,5 мл
x= 0,0895 (л) =89,5 мл  90мл.
90мл.
V(NH3·H2O) = 90мл V(NH4Cl) = 110мл
Пример 3 а) Рассчитайте рН ацетатной буферной системы, приготовленной смешением 200мл 0,1м СН3СООН и 200мл 0,1М СН3СООNa. рКа(СН3СООН) = 4,76.
б) Рассчитайте рН данной буферной системы после добавления 10мл 1М HCl и буферную ёмкость по кислоте.
в) Рассчитайте рН данной буферной системы после добавления
10 мл1М NaOH и буферную ёмкость по щёлочи.
Решение:
а) рН ацетатной буферной системы равна: рН= 4,76 + lg 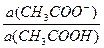
Концентрации буферных кислоты и основания равны:
c(CH3COO-) = с(СH3COOH) = 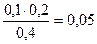 моль/л
моль/л
Для определения коэффициента активности определяем ионную силу:
J=0,5(0,05 + 0,05)= 0,05. 
Концентрацией ионов, которые даёт слабый электролит – уксусная кислота пренебрегаем в виду их малости.
Из таблицы находим коэффициенты активности ацетат – иона и иона натрия:f=0,84.
Рассчитываем рН буферной системы:
pН = 4,76 + lg 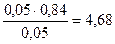
б) При добавлении соляной кислоты протекает реакция:
CH3COO- + H3O+ = CH3COOH +H2O,
0,02 0,01 0,01 моль
В растворе было:n(CH3COO-) = 0,05·0,4 = 0,02 моль. Добавили n(HCl) = 0,01·1 = 0,01моль.
При этом сильная кислота заменяется в эквивалентных количествах на слабую (буферную) кислоту, а буферное основание в эквивалентных количествах уменьшается. (В этом заключается механизм буферного действия).
В результате реакции буферного основания осталось: 0,02 –0,01 = 0,01 моль,
а буферной кислоты стало: 0,02 + 0,01 = 0,03 моль.
Поскольку количество ионов в результате такой реакции не меняется, ионная сила не изменяется и коэффициент активности остаётся прежним.
Тогда рН = 4,76 + lg 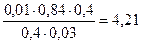
Буферная ёмкость по кислоте равна: Bк = 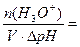
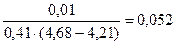 моль/л.
моль/л.
в) При добавлении щёлочи в буферную систему протекает реакция:
CH3COOH + OH- = CH3COO- + H2O
0,02 0,01 0,01 моль
В растворе было: n(CH3COOH) = 0,05·0,4 = 0,02моль. Добавили n(NaOH) = 0,01·1моль.
При этом сильное основание ОН- заменяется в эквивалентных количествах на слабое(буферное основание), а буферная кислота в эквивалентных количествах уменьшается. В результате реакции буферной кислоты осталось: 0,02 –0,01 = 0,01 моль, а буферного основания стало:
0,02 + 0,01 = 0,03 моль. Поскольку ионная сила не меняется, коэффициент активности остаётся прежним 0,84.
Тогда рН = 4,76 + lg 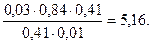
Буферная ёмкость по щёлочи равна: Вщ = 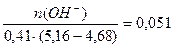 моль/л.
моль/л.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1445; Нарушение авторских прав?; Мы поможем в написании вашей работы!