
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы
|
|
|
|
Химические системы
Тесты по теме
1.Какой тип связи имеет место в молекуле NH3? Относительная ЭО: 3,0 (N);
2,1 (H).А) ковалентная полярная; б) ковалентная неполярная; в) ионная.
2.Какая из связей наиболее полярная? а) H-J; б) H-F;в) H-Сl.
3.В какой из молекул связь - ионная? а) AsH3; б) CaBr2; в) Н2S.
4.Какой тип связи имеет место между элементами с одинаковыми значениями ЭО? а) ионная; б) ковалентная полярная; в) ковалентная неполярная
5.Какие связи имеют место в комплексном ионе BF4-?
а) ковалентные полярные и координационная; б) ковалентные полярные;
в) ковалентные неполярные и координационная.
Химические системы - системы, состоящие из нескольких химических соединений, взаимовлияние которых друг на друга определяют свойства всей системы в целом. К ним относятся растворы, дисперсные системы, электрохимические системы, каталитические системы.
Растворы (истинные) - гомогеннные смеси переменного состава. Они могут быть газовыми (воздух), жидкими (морская вода) и твердыми (однородные металлические сплавы). Обычно термин «растворы», не содержащий уточнений, относят к жидкой молекулярно-дисперсной системе. Растворителем называется компонент, концентрация которого значительно выше концентраций остальных компонентов. Наибольшее значение имеют растворы, в котором растворителем является вода.
Важной характеристикой растворов является их концентрация.
3.1.1. Различные способы выражения концентраций
Процентная концентрация (С%) - число граммов растворенного вещества в 100 граммах раствора. Например, 5% раствор поваренной соли содержит 5г соли в 100г раствора. Рассчитать С% можно по формуле:
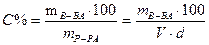 , где mв-ва, mр-ра – масса растворенного вещества и
, где mв-ва, mр-ра – масса растворенного вещества и
масса раствора (г); V× - объем раствора, мл;
d - плотность раствора г/мл.
Молярная концентрация (См, моль/л) - число молей растворенного вещества в 1 литре раствора. Например, 0,1м раствор поваренной соли содержит 5,85г соли в 1 л раствора. Рассчитать См можно по формуле:
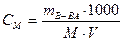 , где М – молекулярная массы растворенного г/моль;
, где М – молекулярная массы растворенного г/моль;
V - объем раствора, мл.
Нормальная концентрация (N, г-экв/л) – число грамм-эквивалентов растворенного вещества в 1 литре раствора. Например, 0,1н раствор серной кислоты содержит 4,9г кислоты в 1 литре раствора. Нормальная концентрация широко используется при расчетах в титрометрических методах анализа растворов.
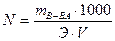 , где Э – эквивалентная масса вещества, г/ моль;
, где Э – эквивалентная масса вещества, г/ моль;
V - объем раствора, мл
Ионные реакции в водных растворах
Химические процессы в растворах протекают быстрее тогда, когда взаимодействующие вещества находятся в одной фазе. Особенно быстро протекают реакции между ионами. Равновесие этих реакций сдвинуто в сторону образования а) слабых электролитов (Н2О, СН3СООН и др.),
б) нерастворимых веществ (осадков), в) газа.
а) NаСН3СОО + НСl = СН3СООН + NaCl
СН3СОО- + Н+ = СН3СООН
б) BaCl2 + K2SO4 = ¯BaSO4 + 2KCl
Ba2+ + SO42- = ¯BaSO4
в) Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
CO32- + 2H+ = CO2 + H2O
Ионное произведение воды
Вода является слабым электролитом. Установлено, что на ионы диссоциирует одна молекула из 10 млн.
Н2О «Н+ + ОН-
Константа равновесия этого процесса при 200С 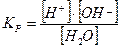 =10 -16
=10 -16
[H2O] – концентрация воды, моль/л – величина постоянная, равная 55, 5 моль/л (1000/18). Подставив это значение в выражение константы равновесия, получают выражение, которое называется ионное произведение воды
Кводы = [Н ] × [ОН-] = 10 –14
Это произведение остается постоянной величиной при добавлении к воде кислот, оснований, солей.
В нейтральной среде: [Н+] = [ОН-] =10-7 (моль/л)
В кислой среде: [Н+] > [ОН-], [Н+] >10-7 (моль/л)
В щелочной среде: [Н+]< [ОН-], [Н+]<10-7 (моль/л)
Проще характеризовать среду с помощью водородного показателя рН – отрицательного десятичного логарифма концентрации водородных ионов:
рН = - lg [H+]
Среда: кислая нейтральная щелочная
рН < 7 рН = 7 рН > 14
Например, если рН = 11, [Н+] = 10-11моль/л, среда – щелочная.
Гидролиз солей.
При растворении солей в воде происходит взаимодействие ионов соли с молекулами воды, в результате которого образуются молекулы слабых электролитов и изменяется рН среды называют гидролизом.
Гидролизу подвергаются соли, в состав которых входят ионы слабых кислот или оснований.
При растворении карбоната натрия (соды) в воде среда становится щелочной (рН>7)
Na2CO3 + H2O «NaOH + NaHCO3
CO32- + H2O «OH- + HCO3-
При растворении хлорида железа раствор становится кислым (рН<7)
FeCl3+ H2O «FeOHCl2 + HCl
Fe3+ + H2O «FeOH2+ + H+
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 541; Нарушение авторских прав?; Мы поможем в написании вашей работы!